LES GLACES : de la physique à la biologie
Pr.
R.Raynal , Dr de l’université de Toulouse
Juillet 2006
L’eau solidifiée présente une grande variété de structures,
cristallines ou amorphes. Les molécules d’eau modifient
leur disposition sous forte pression et en fonction de la
température. Les réseaux formés différents par leurs
propriétés physiques et se retrouvent, au moins
partiellement, dans le système solaire et au delà. D’autre
part, les glaces constituent aussi le milieu de vie d’un
nombre étonnant d’organismes. Elles ont donc un intérêt
exobiologique évident.
Solidified water presents a large variety of structures,
crystalline or amorphous. The water molecules modify their
arrangement under strong pressure and according to the
temperature. The formed networks differ by their physical
properties and are found, at least partially, in solar
system and beyond. Ices constitute also the life medium of
an astonishing number of living beings. Thus, they have an
obvious exobiologic interest.
Brisons
“La” glace
En dessous de 0°C, en présence d’impuretés, l’eau se
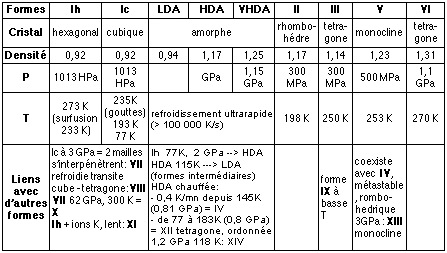
solidifie pour former une structure ordonnée à motif
hexagonal: “la” glace, solide cristallin notée Ih, présente
la particularité de posséder un volume spécifique plus
élevé que celui du liquide, ce qui lui permet de flotter.
Il est possible, en recréant en laboratoire les conditions
physiques présentes à l’intérieur de nombreux corps
célestes (forte pression, température basses) ou à leur
surface (faible pression, température très basses) de
caractériser 16 arrangements moléculaires de la glace (dont
plusieurs états métastables*, voir tableau ci dessous)
parmi un grand nombre de possibilités (1).
Les variétés amorphes permettent l’étude de l’eau liquide
“figée” dans le temps (2).
L’importance des mélanges
Dans les milieux réels, la glace contient de nombreuses molécules (NH3, CH4, CO2, ions métalliques, silicates...) s’insérent dans ses cristaux en modifiant éventuellement leur forme et surtout en conférant au solide obtenu des propriétés nouvelles. Sur Terre (permafrost) et dans le système solaire, les mélanges glace/NH3/CH4 sont particulièrement fréquents. La glace peut aussi constituer des clathrates, “cages moléculaires” susceptibles d’emprisonner des composés organiques comme le méthane (hydrates de CH4 terrestres à forte P et faible T)
Un surprenant milieu de vie
Même dans la glace, il existe de l’eau liquide qui forme un réseau tridimensionnel comprenant des canaux micrométriques reliant des films nanométriques d’eau liquide entourant des impuretés (jusqu’à -40°C) permettant le maintient de ce réseau liquide jusqu’à -95°C (3). Ce réseau constitue le milieu de vie de plusieurs espèces microbiennes en antarctique, au groenland et dans des glaciers (Sajama en Bolivie).
Plusieurs végétaux et animaux vivent à l’intérieur de poches liquides saumâtres contenues dans les glaces polaires (4), la glace de mer étant un semi solide où des canaux submillimétriques d’eau liquide relient de sombres poches de saumure dans lesquelles les sels minéraux, expulsés de la glace et à forte concentration, permettent le maintient de l’état liquide. La forme et l’extention de ces réseaux varient rapidement en fonction de la température, de la salinité et du couvert neigeux.
L’activité biologique induit une forte concentration en matière organique dissoute, un pH élevé (même si le taux de NH3 est élevé aussi), et une faible disponibilité des nutriments. La banquise constitue une source d’azote alimentaire de première importance pour le krill, qui se nourrit d’algues diatomées, qui colorent la glace en brun. Outre des bactéries psychrophiles qui se nourrissent des débris organiques provenant des autres organismes, de nombreux protistes et petits copépodes sont également présents dans la glace, consommant algues et bactéries.
D’étonnantes adaptations au froid et à l’obscurité.
Même si la croissance et le développement des micro-organismes demandent une température élevée, il n’existe pas de preuve qu’une température minimale est nécessaire au métabolisme (qui évolue indépendamment du milieu, sol ou glace), ce dernier étant toujours actif à -40°C (5) où une faible quantité d’eau liquide est disponible. Plus généralement, le taux de réparation moléculaire à basse température égale le taux d’altération, permettant la survie bactérienne pendant des durée supérieures à 100 millions d’années. Néanmoins, cette survie exige des adaptations spécifiques.
La faible luminosité (1,5 m de glace la réduit de 97 %) sélectionne les algues capables de photo-acclimatation, qui réagissent en multipliant par 200 leur fabrication de pigments photosynthétiques, chlorophylle où fucoxanthine pour les diatomées. Par contre, les mécanismes d’adaptation de la respiration restent inconnus.
Le confinement entraîne des difficultés liées à l’hyper oxydation du milieu. Les micro-organismes et les eucaryotes réagissent en produisant plus d’antioxydants (catalase, glutathione peroxydase et réductase), et ceux qui réalisent la photosynthèse peuvent même diminuer leur production d’O2 en devenant hétérotrophes. Le manque d’azote gène la synthèse protéiques et dégrade les chloroplastes, qui doivent être protégés par production de nouveaux acides gras stabilisants leurs membranes.
Les situations de choc osmotique liés à la salinité variable du milieu sont contrés par des enzymes tolérant au sel et la synthèse de molécules (proline, mannitol, glycine betaine) concentrant le milieu intérieur et lui permettant de conserver son eau liquide.
Les basses températures (< -18°C) posent un ensemble de problèmes dont les solutions sont variées. Ainsi, les cristaux de glaces pouvant entamer les membranes cellulaires sont neutralisés par la formation, mal connue, de biofilm de polysaccharides jouant aussi un rôle tampon et haloprotecteur. Algues et bactéries libèrent aussi des glycoprotéines facilitant leur adhésion à la glace.
Le maintient de la fluidité des membranes lipidiques à - 20°C est obtenu avec une synthèse d’acides gras insaturés et poly-insaturés et une diminution de la longueur de leurs chaînes carbonés. Les membranes des thylacoides sont ainsi modifiées, accroissant le flux électronique dans les photosystémes et augmentant l’efficacité de la photosynthèse (favorisée aussi par l’augmentation de la concentration en enzyme RUBISCO). Les diatomées synthétisent un agent cryoprotecteur , le DMSP (di-méthyl-sulfoniopropionate) qui, libéré au contact de l’eau à la fonte des glaces, donne du SO2, du méthane sulfonate et des sulfates favorisant la formation de nuages.
L’affinité pour les nitrates diminue aussi avec la température, générant une forte dépendance envers l’azote minéral par ailleurs présent, sous forme NH4 ou NH3, en grande quantité.
Les glaces constituent donc des milieux d’une grande variété de structures et de propriétés physiques susceptibles d’abriter des écosystèmes dont les manifestations et la perennance sont surprenantes. Ces données ouvrent la voie à une recherche de formes de vies extraterrestres dans les glaces du système solaire.
Références
0 - Zubavicus Y , Grunze M - New Insights into the Structure of Water with Ultrafast Probes Science 304, 14/05/2004.
1- Tulk C. A. et al., Science 297, 1320 (2002).
2- P. H. Poole, F. Sciortino, U. Essmann, H. E. Stanley, Nature 360, 324 (1992).
3- P. B. Price, N. Bramall, K. Tatebe Microbial life in ice and subglacial environments Geophysical Research Abstracts, Vol. 5, 07228, 2003
4 - D. N. Thomas , G. S. Dieckmann. Antarctic Sea Ice a Habitat for Extremophiles Science 295, 25/01/2002.
5 - P. Buford Price, Sowers T. Temperature dependence of metabolic rates for microbial growth, maintenance, and survival. PNAS 30/03/ 2004 vol. 101,13 4631–4636
Web: http://www.lsbu.ac.uk/water/ice1h.html