Récepteur de l'IAPP
Dépôts amyloïdes chez les diabétiques
IAPP & apoptose des cellules B
Formation des fibres amyloïdes
Rôle de l'IAPP dans le diabète
Fonction(s) de l'IAPP chez l'individu sain
L'IAPP est un polypeptide de 37 acides aminés (AA) présent chez tous les mammifères. Il est fabriqué par les cellules B du pancréas, et sécrété avec l'insuline. Sa concentration sanguine chez l'adulte sain est de 1.56 +/- 0.27 pmol/l (Zapecka-Dubno & al., 1999). Il existe un analogue de l'IAPP utilisé en recherche clinique appelé pramlintide.
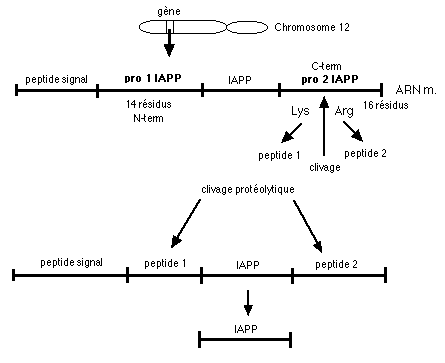
Ce polypeptide est synthétisé à partir d'une séquence portée par le chromosome 12, qui code pour un précurseur de 89 AA dont les 22 AA N terminaux servent au transport via le reticulum endoplasmique. Le précurseur subit un clivage protéolytique qui aboutit à l'IAPP mature. Outre les cellules B, de l'ARNm d'IAPP a été mis en évidence dans le tube digestif et dans la moelle épinière (ganglion de la racine dorsale) chez le rat. En outre, des cellules immunoréactives à l'IAPP ont été décrites dans les muqueuses gastriques et duodénales.

Chez l'homme mais aussi le singe et le chat, cette molécule forme des fibrilles amyloïdes pancréatiques au cours de pathologies telles que le DNID ou l'insulinome. Ces fibres se forment dans les îlots chez plus de 90% des patients diabétiques (72% ayant plus de 40 ans) et chez 18% des sujets normaux représentant un état prédiabétique.
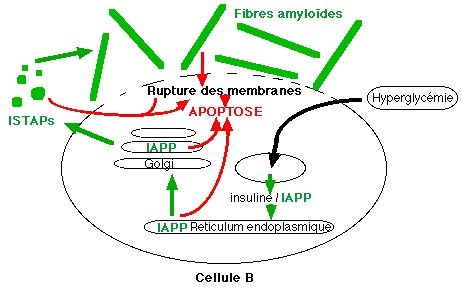
A l'état normal, le rapport de sécrétion IAPP/insuline est constant au niveau des cellules B. Une augmentation de la glycémie entraîne une augmentation conjointe de la sécrétion d'insuline et d'IAPP mais, in vitro, l'exposition de cellules B à de fortes concentrations en glucose (20 mmol/l) augmente la proportion d'IAPP et de ses précurseurs par rapport à celle de l'insuline: l'hyperglycémie favorise la formation de l'IAPP dans les cellules B (Hou & al, 1999).
Cette altération de la cosécrétion insuline/IAPP va dans le sens d'une surproduction d'IAPP associée à une diminution de la sécrétion insulinique. La surproduction d'IAPP va provoquer son accumulation dans la cellule B (l'immunoréactivité de ces cellules à l'IAPP augmente). Les gènes de l'IAPP et de l'insuline, bien que n'étant pas situés sur le même chromosome, ont des promoteurs similaires. Bien qu'une expression accrue du gène IAPP entraîne une surproduction d'IAPP caractéristique de l'aggravation de l'état diabétique, le gène de l'IAPP est exprimé normalement chez les diabétiques. La formation des dépôts amyloïdes serait donc reliée à un dysfonctionnement post transcriptionnel intervenant au niveau du pré-pro-IAPP.
|
Après 15 mois de ligature du canal pancréatique, des dépôts amyloïdes sont mis en évidence sous forme de bâtonnets verts biréfringents orientés et parallèles au sein du collagène chez le lapin |
 |
Lys-cys-asn-thr-ala-thr-cys-ala-thr-gln-arg-leu-ala-asn-phe-leu-val-his-ser-ser-asn-asn-phe-gly-ala-ile-leu-ser-ser-thr-asn-val-gly-ser-asn-thr-tyr - N
en rouge: séquence fibrinogène dite AILS
|
Chez le lapin, cette séquence devient: Lys-cys-asn-thr-ala-thr-cys-ala-thr-gln-arg-leu-ala-asn-phe-leu-ile-his-ser-ser-asn-asn-phe-gly-ala-ile-phe-ser-pro-pro-ser-val-gly-ser-asn-thr-tyr - N en rouge: séquence fibrinogène dite AIFS Ci contre: fibres amyloïdes obtenues à partir d'un décapeptide de synthèse reprenant la séquence de l'IAPP de lapin en position 20-29. photo C. Cortie
|
 |
La séquence de l'IAPP humain est à 50% identique à celle du CGRP (Calcitonin Gene Related Peptide). Le CGRP est un peptide ressemblant à la calcitonine, et dont le gène est lié à celui de cette hormone :
Ce peptide est en particulier exprimé dans certaines cellules cervicales. L'action du CGRP mimerait celle de la calcitonine, à savoir un effet hypocalcémiant (avec action au niveau rénal, osseux et digestif) mais également un effet vasodilatateur et cardiostimulant. IAPP et CGRP sont également connus pour interagir ensemble au niveau des capillaires sanguins de certaines zones de l'organisme (Hall JM, et al., 1999).
Une autre ressemblance entre IAPP et calcitonine est que cette molécule peut également former des fibres amyloïdes dans le carcinome médullaire de la thyroïde: en réponse à des modifications (à définir et étudier) de leur milieu de synthèse, ces deux molécules présentent des réactions similaires.
Récepteur de l'IAPP
L' IAPP comme la calcitonine réduit le taux plasmatique de calcium et possède des effets vasodilatateurs. Cependant, il se lie difficilement aux récepteurs de la calcitonine (son affinité pour le récepteur est 100 fois inférieure) alors qu'il présente la même affinité (faible) que le CGRP pour les récepteurs de l'adrénomedulline (Poyner & al., 1999). L'IAPP doit donc posséder ses propres récepteurs (Muff R & al., 1999), de structure proche de celui de la calcitonine ou du CGRP. Des résultats récents suggérent que l'IAPP interfére avec les mécanismes de la neurotransmission dopaminergique via les récepteurs du CGRP (Clementi & al., 1999). De plus, un récepteur commun iapp/ CGRP (possédant une meillure affinité pour l'IAPP) a été mis en évidence sur des osteoblastes de rat dont ces ligands stimulent la croissance in vitro (Cornish & al., 1999).
Ainsi, des sites de liaison à l'IAPP manifestant une forte affinité pour cette molécule ont été mis en évidence au niveau du cortex rénal (Wookey & Cooper, 1998). Il s'agit d'un récepteur comportant 7 unités transmembranaires capable de former un complexe avec une protéine G et d'induire, donc, une action intracellulaire via un second messager. Un récepteur de type C a également été mis en évidence au niveau des neurones de l'organe sub-fornical , une glande neurocrine encéphalique (Riediger, Schmid & al., 1999) ou l'IAPP agirait de concert avec la calcitonine pour provoquer l'exitation de ces neurones.
Il semble bien qu'il existe en fait un recepteur unique et plurifonctionnel pour la calcitonine, le CGRP et l'IAPP: l'affinité de ce récepteur pour ces différents ligands serait modulée par une famille de protéines intramembranaires, les Ramps (Receptor Modified Activity Proteins). 3 de ces molécules ont actuellement été identifiées (Latchie & al, 1998)
Au niveau musculaire, la molécule P20 dont la phosphorylation est modifiée par l'IAPP peut être considérée comme un des médiateurs intracellulaires de la liaison IAPP/récepteur. De plus, l'IAPP semble agir dans ces cellules via deux voies moléculaires différentes (Wang & al., 1999).
Dépôts amyloïdes chez les diabétiques
IAPP & apoptose des cellules B
Chez les diabétiques, des dépôt amyloïdes peuvent être effectivement associés à une hypersécrétion de proinsuline. La sécrétion accrue d'IAPP peut directement déclencher l'apoptose des cellules B selon une voie intracellulaire (Hiddinga & al., 1999) mais les dysfonctionnements de la cellule B entraînent également la production de dépôts amyloïdes insulaires qui peuvent augmenter le volume des îlots et détruire les membranes plasmiques des cellules B, aggravant ainsi l'état diabétique. Les fibres amyloïdes sont en effet toxiques pour les cellules B: au contact de la membrane cellulaire, ces fibres déclenchent l'apoptose de ces cellules.
 |
|
|
|
Présence de fibres amyloïdes juxtanucléaires dans une structure néoformée (syncitium ou cellules B) pancréatique chez le lapin 15 mois après ligature du canal pancréatique. micrographie électronique - N noyau - L lysosome - Mf microfibrilles - granulations a et b. photo originale Dr C. Cortie |
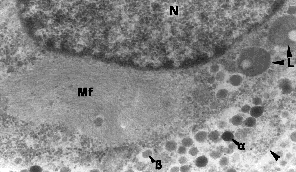 |
Des différences apparaissent quant à la localisation des fibres amyloïdes chez des animaux appartenant à des familles différentes. Ainsi, chez le singe et le chat les dépôts de fibres amyloÏdes sont extracellulaires. la souris transgénique exprimant les gènes de l'IAPP humain montre une formation de fibres amyloïdes intra et extracellulaires avec une polymérisation débutant à l'extérieur de la cellule (MacArthur & al., 1999) alors que chez l'homme les dépôts sont surtout intracellulaires (Westermark G & al., 1999). La photo ci dessus nous montre que cette disposition intracytoplasmique est également retrouvée chez le lapin ayant subi une ligature du canal pancréatique, ce qui rapproche encore ce modèle injustement méconnu des phénomènes observés chez l'Homme.
Les fibres amyloïdes formées a partir de l'IAPP dans le pancréas ont une structure secondaire caractérisée par la formation de feuillets b plissés. Des dépôts amyloïdes présentant une structure comparable sont impliqués dans de nombreuses pathologies dégénératives ( maladie d'Alzheimer, amyloïdoses, encéphalopathies spongiformes,polyneuropathies, angiopathie amyloïde cérébrale héréditaire, carcinome médullaire de la thyroïde ainsi qu'une dizaine d'amyloïdoses - Kelly, 1996).
Ces pathologies sont liées à un repliement incorrect de peptides ou de protéines qui forment alors des fibres: la formation de fibres amyloïdes in vivo concerne 16 peptides ou protéines humaines qui peuvent s'assembler anormalement pour former des fibres de 60 à 100 Å et devenir généralement neurotoxiques (Yon-Kahn, 1996). Ceci implique un changement de conformation spatiale qui conduit à la formation d'un intermédiaire de repliement à partir duquel peuvent se former par autoassemblage des fibrilles amyloïdes. Ce changement de conformation a été particulièrement étudié pour la protéine PrP impliquée dans la maladie d'Alzheimer et pour la transthyrétine (protéine plasmatique assurant le transport de la thyroxine par fixation directe de l'hormone et celui du rétinol par association indirecte avec la protéine qui fixe le rétinol - cette protéine peut se transformer en structure amyloïde et conduit ainsi tardivement (80 ans environ) à une amyloïdose systémique sénile ).
La formation des fibres amyloïdes implique quant à elle une transition entre un état soluble de l'IAPP et sa forme fibrillaire, insoluble, et présentant une structure secondaire riche en feuillet Bêta. Cette transition conformationnelle débuterai à partir d'une forme "fibrillogène" de l'IAPP, partiellement repliée en feuillets béta, et qui serait présente en même temps et en équilibre avec la forme "afibrillogène" de l'IAPP (Kayed & al., 1999). La formation des fibres commence in vitro par un processus de nucleation à partir du précurseur bêta, processus qui s'accélère ensuite fortement quand la polymérisation est lancée. Toute altération de cet équilibre entre les deux géométries des conforméres d'IAPP pourrait donc entraîner la polymérisation de fibres amyloïdes. (On retrouve ici un effet pathogène causé par un changement de conformation d'un peptide, tout comme dans les maladies à prions...). Des observations réalisées par microscope à force atomique (Goldsbury & al., 1999) ont montré que la polymérisation de fibrilles est bidirectionnelle et se produit de façon rapide (avec une vitesse voisine de 1nm/mn in vitro). Cependant, l'absence de formation de fibres amyloïdes dans de lignées de cellules B pancréatiques humaine sécrétant par ailleurs normalement de l'IAPP (Andrikopoulos & al., 1999) semble indiquer que la polymérisation demande un facteur déclenchant encore inconnu à ce jour. Des études menées sur les souris transgéniques mettent cependant en évidence un lien entre la polymérisation de l'IAPP et les diverses sécrétions des cellules B (MacArthur & al., 1999 - abstract - lien vers site de l'auteur).
Hypothèse personnelle: le glucose ne pourrait il pas jouer un rôle direct dans le changement de conformation à l'origine de la polymérisation de l'IAPP ? En effet, le glucose peut réagir directement avec la fonction amine des peptides pour former des bases de Schiff, puis des produit d'Amadori (l'hémoglobine glycosylée en est un bon exemple) aboutissant à un produit de glycosylation pouvant créer des liaisons croisées entre acides aminés (Cerami & al., 1987), et donc modifier la structure secondaire de ceux cis.
Rôle de l'IAPP dans le diabète
Outre ses effets délétères sur les cellules B (apoptose), l'IAPP est également impliqué dans de développement de l'insulinorésistance des tissus périphériques: Chez la souris obèse ob/ob, qui devient rapidement insulinorésistante, la production d'IAPP est fortement augmentée (multipliée par 25!) pendant le vieillissement de l'animal (après 21 semaines) corrélativement à l'installation d'une forte hyperinsulinémie (Leckstrom & al., 1999). Si l'on intègre le gène ob à des souris transgéniques exprimant l'IAPP humain (Hoppener & al., 1999), on constate alors la formation d'ilots amyloïdes mais surtout l'apparition d'une forte insulinorésistance (ces souris ob deviennent hyper glycémiques, ce qui n'est pas le cas sans le gène de l'IAPP humain ou elles sont normoglycémiques mais hyperinsulinémiques) et une forte insulinopénie (division par 4 du taux plasmatique d'insuline!).
Nous nous retrouvons donc avec la séquence d'évènements suivants:
Au début du diabète, l' IAPP altère la réponse des cellules B au glucose et provoquerait l'apoptose des cellules en proliferation rapide tandis qu'après s'étre accumulé, à un stade ultérieur, il provoque la destruction des cellules B par apoptose et modifie les capacités sécrétoires des cellules B (Hrnciar, 1996).
Fonction(s) de l'IAPP chez l'individu
sain
Le ou les rôles exacts de l'IAPP sont encore sujets à caution. Des résultats intéressants ont été obtenus par l'étude de souris transgéniques exprimant une grande quantité d'IAPP humain, et ils montrent que cette molécule inhibe spécifiquement la réponse insulinique à une surcharge glucosée d'origine alimentaire (empruntant le tube digestif) alors qu'elle n'agit pas si le glucose est directement apporté par voie intraveineuse (Ahren B & al., 1998).
Outre cet effet de nature à renforcer la glycémie, des résultats variés montrent que l'IAPP est nettement impliqué au niveau cérébral (Morimoto & al., 1998):
C'est cette diversité et son implication avec d'autres hormones qui rend son étude difficile. Ainsi, l'IAPP est impliqué dans l'homéostasie et agit au niveau rénal, en liaison avec l'angiotensine II (Wookey & Cooper, 1998). Il jouerait donc un rôle dans la genèse de l'hypertension (Wookey, Cao & al., 1998). Il est également connu pour stimuler la croissance des ostéoblastes in vitro, mais aucun effet sur le métabolisme osseux n'a été observé chez des humains diabétiques de type I (donc déficients en iapp) et traités par un de ses analogues (Borm & al., 1999).
Si nous tentons de faire un bilan des effets constatés de l'IAPP chez l'Homme sain, nous aboutissons à la liste suivante:
et dans le diabète de type II, nous devons rajouter:
Ce qui nous pousse à constater (tout comme Karlsson, 1999 et Kruger, 1999) que l'IAPP doit bien être considéré comme une hormone pancréatique , à l'instar de l'insuline ou du glucagon, exerçant ses effets (variés et discrets) sur le comportement alimentaire et les sécrétions pancréatiques qui y sont afférentes.
Questions ouvertes &
idées folles
L'IAPP posséde une vaste palette d'actions. Peut on les mettre en évidence chez d'autres animaux, dans d'autres groupes (chez les reptiles, les amphibiens, les poissons...).
Quels sont les liens exact entre IAPP et homéostase ?
Pourquoi dénier encore le statut d'hormone à l'IAPP alors que cette molécule est produite par des cellules endocrines (B), transportée par le sang, se fixe sur des récepteurs spécifiques (identifiés dans le rein) sur des cellules cibles et y déclenche via un second messagers des effets spécifiques. Ne sont ce pas là les caractéristiques d'une hormone ?
Il faudrait éclaircir les rapports
entre calcitonine, CGRP et IAPP. Ces trois molécules de
séquence voisine sont capables de former des fibres
amyloïdes. Peuvent elles dériver d'un gène
ancestral unique ? Il a été montré (Srinivasan & al.,
1998) qu'une apoptose neuronale calcium dépendante
est impliquée dans les neuropathies des diabétiques de
type II. Une accumulation de calcium
a été détectée dans les cellules
pancréatiques chez le lapin
après 450 jours de ligature du canal pancréatique
(voir
photo), voisinant avec des microfibrilles
amyloïdes d'IAPP. L'apoptose
des cellules B déclenchée par l'IAPP serait elle
calcium dépendante?
Le troisiéme ventricule (ou ventricule
moyen) est situé au centre du cerveau, entre les 2 thalamus.
Cette cavité communique avec les venticules latéraux
par les trous de Monro et avec le ventricule 4 par l'aqueduc de
Sylvius. L'organe sub fornical fait partie des organes
épendymaires (glandes neurocrines) du troisième
ventricule. Il est situé sur la paroi antérieure du
télencéphale médian, entre les deux trous de
Monro.