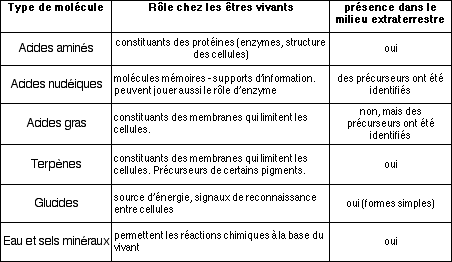
Nous pouvons
à présent construire
un scénario crédible décrivant comment la
vie a pu apparaître sur une planète. Une remarque
s'impose: contre l'évidence première, rien ne montre
que la vie est bien apparue sur Terre. Nous verrons que des formes
de vie bactériennes ont pu, ont dû ensemencer notre
monde, sans doute plusieurs fois.
Cependant, il a bien fallu que ces "bactéries", quelle que soit leur origine, apparaissent un jour. Nous allons donc nous baser sur les deux types planétaires différents que nous connaissons: les planètes telluriques, dont le prototype est notre Terre, et les planètes joviennes, avec l'exemple de Jupiter, et obtenir deux voies conduisant à l'apparition de formes de vie microbiennes.
· Pourquoi se limiter aux bactéries ?
Ce sont les formes de vie les plus anciennes que nous connaissons. Expliquer l'apparition de la vie correspond donc à expliquer par quel moyen les ancêtres des bactéries ont pu apparaître. Pour ce qui est des autres êtres vivants, nous dirons qu'ils sont plus ou moins apparentés, et que la description de l'évolution des organismes, outre qu'elle soit mal connue, sort du cadre de cet ouvrage !
Point de départ: le jeune système solaire
Nous sommes il y a 4 milliards d'années. Dans le système solaire, nous allons trouver 3 milieux impliqués dans l'apparition de la vie: les poussières d'origine interstellaire, l'atmosphère des planètes joviennes et la surface des planètes telluriques.
Les poussières, pourvoyeuses de matière organique
Nous avons vu que la surface des poussières interstellaires permettait des synthèses aboutissant à des molécules variées: acides aminés, cycles carbonés, hydrocarbures... Dans les régions lointaines du système solaire, à environ une A.L. de notre étoile, ces poussières s'agrègent pour former des noyaux cométaires en grand nombre. De temps à autre, déstabilisés par le passage d'étoiles proches ou les configurations des planètes du système solaire, certains de ces noyaux plongent vers le soleil. Ils étaient bien plus nombreux à cette époque que de nos jours, transportant non seulement de la matière organique mais aussi de grandes quantités d'eau. Les collisions avec les noyaux cométaires et les météorites ont touché toutes les planètes, mais n'ont laissé de traces que sur les planètes telluriques qui ne sont pas soumises à l'érosion comme Mercure, la Lune et, dans une moindre mesure, Mars.
On pourrait croire que la rentrée dans l'atmosphère détruit toutes les molécules complexes, mais cela est faux: l'altération d'un mobile dans l'atmosphère dépend de son énergie cinétique, conditionnée par sa masse et le carré de sa vitesse, ainsi que par la façon dont le matériau réagit à la chaleur. Les chercheurs ont découvert avec surprise que, vu leur faible masse, les poussières atteignent sans dommage notre planète. Rappelons que même les météorites d'une certaine taille voient leur coeur s'échauffer très peu lors de la traversée de notre atmosphère, ce qui permet aux molécules organiques qu'elles contiennent, comme les acides aminés, de parvenir intactes au sol: dans les océans primitifs de la Terre et de Mars, à la surface des satellites de Jupiter et de Saturne ou au niveau de la haute atmosphère de ces planètes géantes. Un chercheur français, Michel Maurette, s'est spécialisé dans la recherche et l'analyse des micro-météorites qu'il recueille en antarctique. Il a montré que 80 % de celles qui ont une taille comprise entre 50 et 100 µm n'ont pas été fondues lors de leur traversée de l'atmosphère et contiennent environ 7% de matière carbonée, parmi laquelle des molécules comme l'acide a amino-isobutyrique.
· Quelles sont les traces de l'origine stellaire des molécules prébiotiques?
L'origine extraterrestre des monomères du vivant nous permet de contribuer à résoudre l'irritant problème de ce que l'on appelle la chiralité du vivant: la popularité du carbone dans les édifices moléculaires conduit à un étonnant problème de géométrie dans l'espace.
L'atome de carbone peut former 4 liaisons avec d'autres atomes, il occupe alors le centre d'un tétraèdre. Dans les acides aminés et les nucléotides, au moins un atome de carbone (dit a) porte 4 "partenaires" différents et devient alors asymétrique: on ne peut plus le superposer à son image dans un miroir (comme vos mains!). On a donc des acides aminés "droits" D et des acides aminés "gauches" L, et il en est de même pour les nucléotides. Ces deux formes (on parle d'énantiomères) possèdent les mêmes propriétés chimiques. Elles devraient donc se rencontrer à part égale chez les êtres vivants. Et pourtant... ce n'est pas le cas! Les molécules du vivant sont construites presque exclusivement avec des acides aminés L et des nucléotides D. Pourquoi cette préférence?
Bien qu'un trop léger (1/1017!) excès de stabilité chimique affecte les acides aminés L, celui-ci est trop insignifiant pour expliciter leur "sélection" dans le vivant. Il semble bien que celle-ci découle directement des molécules présentes dès le départ, et qui devait donc contenir un énantiomère L en excès notable. Ceci nous éclaire sur les processus de synthèse des acides aminés, car la plupart des phénomènes étudiés aboutissent à des synthèses équilibrées des formes D et L. Une façon d'obtenir un enrichissement en un énantiomère est d'utiliser un milieu de synthèse asymétrique. Ce milieu, difficile à obtenir sur Terre, peut être plus facilement trouvé dans l'espace où le rayonnement synchroton polarisé circulairement d'une étoile à neutron peut orienter la synthèse des acides aminés vers un excès isomérique. D'autres rayonnements polarisés circulairement, dans l'infrarouge, ont été identifiés dans les régions de formation stellaire et peuvent contribuer à cette orientation de la synthèse des acides aminés. Ces idées sont corroborées par l'étude des acides aminés de la météorite de Murchison, qui montre pour certains un excès de 10 % d'une des formes optiques. Les phénomènes autocatalytiques des premiers organismes peuvent ensuite avoir amplifié ce déséquilibre originel. Même un faible excès d'un des deux types d'acides aminés peut avoir été amplifié secondairement pour aboutir à la situation actuelle: l'équipe d' A. Saghatelian, de l'institut de recherche Scripp, a synthétisé un peptide en forme d'hélice, de 32 acides aminés, qui est capable de s'autoreproduire. Au cours de sa copie, il propage son orientation chirale, donnant naissance a une population homogène de copies de type D ou L selon l'orientation de la molécule de départ. Cette molécule se révèle même capable, malgré sa simplicité, de maintenir l'intégrité de ses copies malgré de légères modifications de séquence: ce simple peptide est doué de fonction dite de "correction d'erreur", et montre qu'un léger déséquilibre énantiomérique initial peut avoir été considérablement amplifié avant même que les premiers êtres vivants n'apparaissent.
De nombreuses recherches sont menées sur ces disproportions entre formes D et L et, une fois n'est pas coutume, des scientifiques français sont même en pointe dans ce domaine. Ainsi, des chercheurs de l'observatoire de Bordeaux cherchent à progresser dans cette voie grâce au projet DREAM (Dosage des Rapports Eniantomériques des Acides aminés dans les Micro-météorites).
Les 20 acides aminés utilisés par les êtres vivants ont donc tous (sauf certaines parois bactériennes et quelques molécules de défense) la même symétrie spatiale L. On peut également se demander pourquoi seulement 20 acides aminés entrent dans le code génétique alors qu'il existe plusieurs dizaines de ces molécules. Il y eut probablement des sélections aléatoires basées sur les richesses en acides aminés des différents milieux, et pas mal d'essais disparus sans laisser de traces...
Pour expliquer l'homochiralité D des acides nucléiques, on peut également faire appel à des précurseurs de l'ARN, les pyranosyl-ARN dont la plus grande résistance et la meilleure sélectivité pourraient expliquer cette sélection isomérique. On ne peut cependant exclure un effet provenant de certains catalyseurs minéraux comme les cristaux de calcite, ou causé par des facteurs physiques comme les forces de Coriolis résultant de la rotation terrestre (cela semble à ce jour bien improbable). La chiralité des acides nucléiques reste un mystère à résoudre.

Les aventures de la polymérisation
· A la surface des planètes telluriques...
Il y a 4 milliards d'années, la croûte terrestre est à peine refroidie. La Terre tourne sur elle-même en 20 h seulement, la Lune n'ayant pas encore eu le temps de freiner sa rotation. Notre satellite est d'ailleurs très proche de la Terre: 130000 km seulement, ce qui occasionne des forces de marée 6 à 7 fois supérieures à ce qu'elles sont actuellement!. De plus, notre Lune boucle son orbite autour de la Terre en 6 jours seulement, accélérant ainsi le rythme des marées d'un facteur 5... D'immenses surfaces rocheuses sont donc alternativement découvertes, exposées aux gaz de l'atmosphère et aux rayonnements, puis recouvertes à nouveau, les composés solubles formés enrichissant progressivement les jeunes océans...
L'activité volcanique, fréquente, libère de nombreux gaz, dont de la vapeur d'eau. Les comètes enrichissent également la planète en eau mais aussi en molécules telles que HCN, CO2, formaldéhyde, méthanol, CO, NH3 et H2S. Les astéroïdes et surtout les micro-météorites se chargent d'amener des composés carbonés comme les acides aminés.
Il en est de même pour toutes les planètes telluriques (exceptée Mercure, trop près du soleil). La température des océans est voisine de 80°C. Une épaisse atmosphère (80% d'eau, 19% de CO2 et 1% d'azote) enveloppe la Terre, mais aussi probablement Vénus et Mars, où plusieurs grandes étendues d'eau atteignent plus de 10 m de profondeur. La température de Vénus est sans doute déjà trop élevée pour que de l'eau liquide y soit disponible, malgré sa forte pression atmosphérique. Par contre Mars offre, à la limite, un cadre plus favorable encore que la Terre à l'éclosion de la vie: son atmosphère doit être moins épaisse vu la faible masse de la planète, et sa température moyenne est nettement inférieure à celle de la Terre tout en restant, à l'époque, assez élevée pour permettre le maintien d'eau liquide.
L'absence d'oxygène, donc d'ozone O3, expose la surface des planètes au rayonnement U.V. solaire (absorbé par 10 m d'eau environ sur Terre). A partir des molécules organiques synthétisées in situ et d'origine extraterrestre, les premiers polymères (peptides et acides nucléiques) vont se former. Cette polymérisation a lieu simultanément dans plusieurs milieux, à des vitesses et avec des rendements différents:
· En milieu aqueux, quelques peptides se forment spontanément.
Les océans primitifs sont soumis à une véritable pluie d'acides aminés et de peptides adsorbés sur des poussières interplanétaires. Cette manne est un des matériaux de base de la synthèse prébiotique. En effet, les grains de poussière possèdent une morphologie particulière, ils forment une véritable mousse minérale microscopique contenant une grande variété de minéraux et apte à entrer en contact avec tous les points de l'environnement planétaire. Leur forme leur permet de jouer un rôle de catalyseur et de piège à molécules: bien que des petites molécules et des monomères puissent pénétrer l'intérieur de ces grains, composés à 80% de vide, les grosses molécules qui s'y forment y restent piégées.
Dans l'atmosphère et en surface, de l'adénine ainsi que d'autres acides nucléiques peuvent se former à partir de HCN d'origine volcanique ou cométaire.
· Dans les zones chaudes, à haute pression, en présence d'eau liquide et de CO, H2S, NH3, Fe, Co et Ni, des réactions chimiques se produisent sur des surfaces cristallines.
Une analogie assez simple permet de comprendre l'intérêt de ce phénomène: imaginez que vous devez assembler les grosses pièces d'un puzzle pour enfant constitué d'une photographie découpée en de nombreux fragments. Quelle chance avez-vous de reconstituer le puzzle en jetant au hasard les diverses pièces en l'air? Travaillant dans un volume, les probabilités sont faibles. Par contre, imaginez à présent que vous glissez une à une les pièces entre deux feuilles de papier: travaillant sur une surface, vous avez bien plus de chance d'assembler les différents morceaux. Il en est de même pour les molécules liées à des structures minérales organiques: maintenues en place, elles peuvent réagir en toute quiétude, sans s'éparpiller.
Les recombinaisons "bi-dimensionnelles" possèdent donc un bon rendement et aboutissent à la synthèse de matière organique: formation de peptides et plus rarement d' ARN riche en purines (xanthine et isoguanine ayant précédé les bases pyrimidiques uracile et cytosine). Ces molécules se forment à partir de précurseurs provenant de la réduction du CO2 atmosphérique par action de H2S sur le sulfure de Fer. Elles aboutissent à la formation de cristaux de pyrite (FeS2) qui fournissent un support aux molécules formées. Expérimentalement, l'équipe de R. Hazen, de l'institut Carnegie, a obtenu toute une collection de molécules organiques dans des conditions similaires. Ces chercheurs ont montrés que les minéraux participaient activement aux réactions chimiques, ne se comportant pas simplement comme un support inerte. Le fer, par exemple, forme des composés organo-métalliques dans lesquels il est entouré par des molécules organiques (tout comme, actuellement, dans les molécules d'hémoglobine de notre sang...).
On aboutit par ces voies de synthèse à des systèmes chimio-autotrophes constituant un métabolisme primitif, autocatalytique, où la formation de pyrite agit comme un fournisseur de pouvoir réducteur.
Ces cycles métaboliques apparaissent de façon très rapide. Dans cette optique, la vie peut avoir pour origine les sources chaudes sous-marines mais aussi des cendres volcaniques et d'autres sources chaudes.
· Au contact des différents cristaux composant les argiles, des polymérisations bi-dimensionnelles aboutissent à la formation, à température modérée, d'acides nucléiques (ARN formés par l'action de la montmorillonite) mais surtout de peptides.
Les minéraux argileux se forment extrêmement facilement, ils sont produits par la désagrégation des roches sous l'influence de l'eau: on obtient des solutions d'acide silicilique et d'ions métalliques qui, en recristallisant, donnent des argiles. Si l'on prend l'exemple des silicates lamellaires (kaolinite, illite), ces matériaux sont constitués d'un empilement de feuillets, symétriques ou non, susceptibles de porter des charges électriques. Lors de la croissance des cristaux, les nouvelles couches obtenues dupliquent la géométrie des charges négatives des cristaux précédents (l'information génétique est alors un réseau de charges négatives due à l'insertion d'atomes d'aluminium dans un réseau Si-O). La croissance et la propagation de ces cristaux est si rapide et facile qu'elle peut même, de nos jours, être à l'origine de phénomènes de "contamination" minérale. Les cristaux, selon leur milieu de croissance, sont susceptibles d'évolution car ils sont soumis à une sélection: survivent ceux dont la croissance est optimale pour un environnement donné, donc ceux qui possèdent une forme particulière (la forme, c'est la fonction!). Acides aminés, nucléotides et polyphosphates interagissent avec ces cristaux: les premiers polymères ARN, chargés négativement, sont attirés par les frontières des domaines cristallins, positives. Les bases de cette molécule peuvent également s'intercaler entre les feuillets argileux, avec intervention des ions Zn et Cu. Les alternances de phases hydratation/déshydratation des argiles peuvent permettre d'emmagasiner puis de restituer de l'énergie utilisée pour des synthèses de peptides (glycine-glycine par exemple). Les premiers polypeptides devaient avoir une séquence peu variée, très répétitive, qui reflétait les taux d'acides aminés disponibles dans le milieu: la glycine mais aussi l'alanine devaient en constituer l'essentiel. Les chercheurs de l'équipe d'A. Brack, du Centre de Biophysique Moléculaire du CNRS à Orléans, ont montré que selon les substances minérales rencontrées ces peptides adoptent préférentiellement soit une forme en hélice, soit en feuillets: les cristaux rencontrés modèlent leur géométrie. Ainsi le molybdène conduit à la formation d'hélice a. Ceci est intéressant mais il faut remarquer que le molybdène, sur Terre, est loin d'être abondant...
Les minéraux facilitent également la synthèse de nombreuses molécules d'un grand intérêt biologique:
Dans l'atmosphère des planètes joviennes
Le 7 décembre 1995, la sonde spatiale Galileo a largué un module qui s'est enfoncé dans l'atmosphère jovienne et a transmis les résultats de ses analyses jusqu'à son écrasement final. Elle nous a appris que la teneur en eau variait considérablement selon les courants aériens qui brassent les nuages joviens, la sonde ayant pénétré dans un "point chaud" quasiment "sec". A des pressions supérieures à 20 bar, la quantité d'eau est plus homogène. L'un des résultats les plus inattendu de cette mission a été la détection d'un taux bien trop élevé d'azote (indispensable aux acides aminés) et de gaz rares (argon, krypton et xénon), ce qui pourrait indiquer que la planète s'est formée dix fois plus loin du soleil que son orbite actuelle, ou bien qu'elle a été fortement contaminée par les noyaux cométaires qui abondent à cette distance du Soleil.
La haute atmosphère de Jupiter contient déjà des molécules organiques: éthylène, acétylène, éthane et benzène qui surmontent des couches plus riches en ammoniac, qui forment des nuages de cristaux à une pression équivalente à la pression atmosphérique terrestre. On y trouve également une molécule intéressante à plus d'un titre, la phosphine (PH3) qui peut constituer une source de groupements phosphates pour la chimie prébiotique. La quantité d'eau augmente à une pression de 3 à 4 bars, où l'on découvre également du CO et une molécule exotique, du germane (GeH4) à une température voisine de 0°C. Les nuages colorés, qui sont assez profonds, sont de composition inconnue (composés phosphorés ou organiques?). On a longtemps cru que la composition de Jupiter devait refléter celle du milieu interstellaire qui a donné naissance au système solaire. Ce n'est apparemment pas le cas, ce qui montre soit une erreur quant aux théories sur la nébuleuse primitive, soit l'existence de transformations chimiques depuis la formation de la planète: une chimie prébiotique, voire des formes de vie, ne pourraient-elles pas avoir eu ces effets, transformant l'atmosphère jovienne tout comme notre propre atmosphère a été modifiée par les bactéries ?
La gravité de Jupiter transforme cette planète en "aspirateur à comètes" et lui assure un apport considérable en matériaux exogènes comme les poussières interstellaires et les météorites. Pour l'instant, ne considérons que la chimie atmosphérique de la planète:
Les expériences de type Miller nous montrent que l'on peut obtenir dans des conditions similaires des acides aminés tels que la leucine, l'isoleucine, la thréonine, l'asparagine, la lysine, la phényl-alanine et la tyrosine ainsi que d'autres de ces molécules qui ne sont pas utilisées dans les êtres vivants: la sarcosine et la b-alanine par exemple.
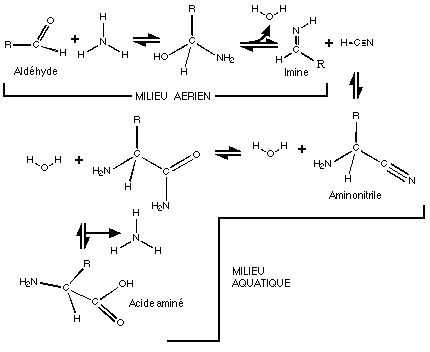
Les monomères peuvent donc commencer à se former en milieu gazeux, dans l'atmosphère. Les premières molécules intervenant sont le cyanure d'hydrogène HCN, le cyanogène C2N2 ainsi que des aldéhydes. Les acides aminés peuvent se former à partir de ces précurseurs, par la synthèse dite de Strecker. Des hydroxyacides, molécules très fréquentes chez les bactéries, peuvent se former de la même façon, comme l'acide glycolique, le glycocolle, l'acide lactique où l'alanine.
Les sources d'énergie disponibles ne sont pas que les U.V., au demeurant pas toujours efficaces pour tous les gaz (ils sont surtout absorbés par H2S et NH3) et dont l'intensité, à la distance de Jupiter, est faible. Les éclairs, la radioactivité ainsi que les ondes de choc des impacts météoritiques et cométaires ont pu apporter l'énergie nécessaire aux synthèses prébiotiques, sans compter les rayonnements éventuels en provenance du coeur chaud de la planète, ou découlant de son activité magnétique. Les éclairs offrent l'avantage de fournir une grande quantité d'énergie à des endroits bien localisés.
Les sucres peuvent être obtenus par condensation formolique, certaines bases peuvent dériver de l'acide cyanhydrique (bases puriques: adénine et guanine) grâce à un intermédiaire, le diaminomaléodinitrile.
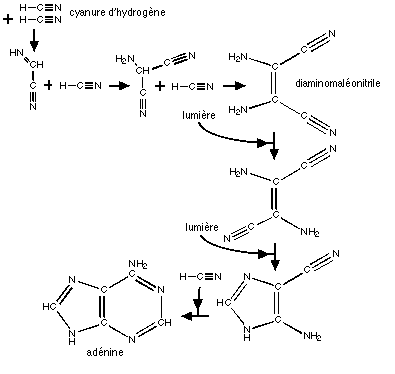
La synthèse des autres bases (pyrimidiques: l'uracile, la thymine et la cytosine) est, ne le cachons pas, plus problématique. Cependant, souvenons-nous que les bases puriques peuvent très bien avoir constitué seules le précurseur de l'ARN, car leur synthèse, relativement aisée, apparaît dans de nombreux scénario différents.
Synthèse des acides nucléiques
La condensation de l'adénine et du ribose donne de l'adénosine, un nucléotide qui en se liant à 3 groupes phosphates donne de l'Adénosine Tri Phosphate (ATP), toujours utilisé pour transférer l'énergie dans les êtres vivants.
On peut se demander pourquoi utiliser l'ATP et non pas la Guanine Tri Phosphate (GTP), la Cytosine Tri Phosphate (CTP) ou l' Uracyle Tri Phosphate (UTP)? La synthèse de l'adénine se révélant plus facile, peut-être cette molécule fut-elle tout simplement celle qui était la plus aisément disponible. La formation de l'ATP est d'ailleurs facilitée, nous l'avons vu, par des minéraux. Les autres nucléotides phosphates sont cependant parfois utilisés pour récupérer de l'énergie.
Un problème de géométrie moléculaire se pose néanmoins pour obtenir les nucléosides : on trouve dans l'ARN une liaison b-1' alors que des a et b-1', 2' et 3' étaient aussi possibles et tout aussi probables. On se retrouve ici aussi avec une ségrégation moléculaire que nous sommes bien en peine d'expliquer!
Sur et dans les poussières interplanétaires
Dans les régions de température assez élevée (ne fantasmons pas, quelques dizaines de Kelvin, soir environ -240°C quand même!), des molécules prébiotiques se forment à la surface de minéraux tels que les argiles et les sulfures. Ces réactions se font dans une gangue de glace, dans un milieu semi-solide. Elles aboutissent à la formation d'acides aminés et, sans doute, d'acides nucléiques.Ainsi, l''inévitable Stanley (Miller) a obtenu la synthèse de bases putiques et pyrimidiques à partir d'une solution de cyanure d'ammonium maintenue 27 ans à -80°C.
Dans les nuages moléculaires, il est possible d'obtenir des liaisons peptidiques mettant en jeu des intermédiaires protonnés. Ces réactions en phase gazeuse ouvrent la voie à la constitution de peptides spatiaux qui peuvent atteindre en grande quantité et sans dommage la surface des planètes telluriques et les atmosphères des planètes joviennes.
La formation des polymères biologiques rencontre plusieurs problèmes
Pour enchaîner les différents monomères, il faut réaliser des réactions de polymérisation. Pour cela, il faut lier deux molécules en leur enlevant une molécule d'eau alors même que dans un milieu aqueux, c'est la dépolymérisation (hydrolyse) qui est favorisée, empêchant l'allongement des polymères protéiques ou nucléiques. Il était donc nécessaire que le milieu favorise la polymérisation. Pour cela, il était impératif de concentrer les réactifs ou d'enlever l'eau, et de coupler la réaction à une autre qui libérerait de l'énergie. En effet, l'allongement d'un polymère nécessite de l'énergie, qui peut être fournie par couplage avec d'autres réactions chimiques par exemple, alors que l'hydrolyse libère de l'énergie, ce qui lui permet de se produire spontanément. La polymérisation doit donc être couplée à une autre réaction lui fournissant l'énergie dont elle a besoin car en milieu aqueux elle n'est pas spontanée. Comment résoudre ce problème, parfois pudiquement évacué par les meilleurs "bio-men "?
· Comment échapper à la dilution fatale ?
La présence d'eau pose un sacré problème à nos réactions chimiques: pour qu'elles se produisent, il faut que les réactifs se rapprochent suffisamment pour pouvoir réagir, et disposent de l'énergie nécessaire à leur liaison. Or, les molécules ont tendance à diffuser dans l'eau, à se disperser: il faut un hasard monstrueux pour qu'elles se rencontrent au moment où, justement, l'énergie nécessaire est disponible. Qui plus est, elles auront alors plutôt tendance à réagir avec l'eau.
Il faut noter qu'une chaîne simple d'acides nucléiques est un poly-ester, et que celui-ci possède une orientation: une extrémité possède un groupe OH libre lié au carbone 3' alors que l'autre bout de la chaîne n'est accessible que par un groupe OH ou phosphate porté par le carbone 5'. Cette orientation est d'une grande importance dans les phénomènes de réplication des acides nucléiques...
La polymérisation des acides aminés présente des caractéristiques similaires: production d'eau et énergie nécessaire. Pour former cette liaison, la fonction amine d'un acide aminé réagit avec la fonction "acide" d'un autre pour donner une liaison CO-NH, avec élimination d'une molécule d'eau. Spontanément, en milieu aqueux, les protéines ont donc tendance à se découper, et non à s'assembler. La formation des premières molécules s'est donc faite dans un milieu comportant assez peu d'eau.
Pourquoi ne pas pousser plus loin encore, et considérer que, tout comme cela fut le cas pour l'oxygène, si l'eau est aujourd'hui indispensable à la vie, cela n'a pas toujours été le cas, celle-ci, au tout début du moins, ayant pour principal problème de se protéger des effets délétères de ce solvant universel ? On pourrait alors oser envisager un début de la vie "à sec", donc possible, jusqu'à un certain point, même dans l'espace interstellaire. Le fait que les réactions de polymérisation soient réversibles, et dans le "mauvais" sens, en milieu aqueux, impose de toute façon l'existence d'une protection vis-à-vis de l'eau. Cette protection a pu être assurée par:
- l'adsorption sur des minéraux argileux du type montmorillonite, qui permet d'offrir une grande surface réactionnelle aux molécules qui sont d'ailleurs orientées par les forces électrostatiques s'exerçant au niveau moléculaire entre les différents feuillets de ces minéraux, le tout en limitant la quantité d'eau présente. Le mélange réactionnel peut être également concentré par évaporation ou congélations successives, en fonction des aléas climatiques.
- des réactions de chimie sèche: S.Fox a montré que des acides aminés secs polymérisent à 130°C. On obtient alors des "thermo-protéinoïdes", des molécules qui seraient les ancêtres des protéines. Avec des polyphosphates, la polymérisation à sec se produit à 60°C. On peut ainsi aboutir à des polymères de 200 acides aminés environ, qui aurait pu se former à la fois en milieu interstellaire et à la surface solide chaude des planètes telluriques.
- des "cages à molécules" : les particules de poussière interplanétaire contiennent de nombreuses cavités dans lesquelles les monomères pénètrent facilement. Ils s'adsorbent aux parois, ce qui les rapproche, ils se lient mais les polymères formés, trop gros, ne peuvent plus ressortir et ne font que croître et prospérer... c'est l'option de base que je développerai pour expliquer l'origine de la vie par celle des ribosomes.
- des microgouttes: les minuscules gouttelettes forment comme un brouillard d'eau dans l'atmosphère jovienne sont des milieux qui concentrent les molécules de monomère qui peuvent y réagir vu le faible volume à leur disposition. Ces gouttelettes forment l'équivalent d'un "océan fragmenté" qui confinent les molécules prébiotiques dans un faible volume.
- le "liquidus", partie liquide d'un mélange aqueux en cours de solidification où se concentrent les impuretés, comme les molécules organiques par exemple.
- un milieu pauvre en eau à l'état liquide comme la glace amorphe des grains interstellaires.
- des membranes à base de terpènes, molécules résultant de la polymérisation de l'isoprène (C5H8)n fois.
Résumons nous: quel que soit le milieu auquel on s'intéresse on se retrouve avec 2 possibilités qui ne s'excluent pas mutuellement:
On aura compris que la formation de chaînes d'acides aminés, peptides ou protéines, ne semble pas poser de problèmes. La principale difficulté vient à présent de la formation des premiers ancêtres des acides nucléiques.
Je propose que la synthèse des prè-ARN ait pu se réaliser dans le milieu interstellaire, où elle a été catalysée par les minéraux des poussières par ailleurs porteuses d'acides aminés. Dès le niveau élémentaire, constitué par les molécules d'origine spatiale, les peptides et les précurseurs des acides nucléiques étaient liés. Ces molécules pouvaient se trouver à la surface des grains, piégées dans une gangue de glace amorphe, ou à l'intérieur des cavités des différents grains. Elles pouvaient aussi être synthétisées au niveau des grains de poussière interplanétaire, se polymériser sous l'effet des rayonnements et se retrouver intégrées, lors de la formation du système solaire, dans des noyaux cométaires ou des astéroïdes.
Il est aussi possible d'obtenir en milieu tellurique une synthèse de nucléosides puriques (ribose + base mais sans phosphate). On obtient alors une grande variété de molécules de pré-ARN puriques. La formation du sucre ribose n'est pas le moindre des problèmes: celui-ci s'obtient assez facilement, mais en trop petite quantité. L'intervention des ions phosphates peut cependant enrichir le milieu réactionnel en ribose. La synthèse d'un précurseur du ribose est également plausible: si on remplace la forme furanose (en pentagone) de la molécule de ribose par sa forme pyranose (en hexagone), on obtient une synthèse plus facile d'un "pyranosyl ARN" aux propriétés intéressantes. Cela laisse penser que l'ancêtre de l'ARN devait être chimiquement assez différent de celui-ci, qui résulte déjà de processus de sélection et d'évolution moléculaire: même pour les molécules, nous n'observons que le résultat final de processus complexes.
Les courtes chaînes de pyranosyl-ARN sont capables en solution de se lier, en effectuant une sélection des diverses formes optiques, et de former ainsi des oligomères se repliant et se liant comme un ARN "à ribose".
Des molécules plus simples peuvent également posséder un comportement intéressant: les molécules de la famille des oligonucléotides (L)-a-thréofuranosyl (TNAs), dérivés d'un sucre à 4 carbones seulement, sont capables de s'apparier et de se lier à la fois avec l'ARN et l'ADN. Ces molécules représentent donc de bons candidats au titre d'ancêtres des nucléotides!
En effet, la capacité de former des appariements antiparallèles (paires de Watson-Crick) est assez répandue chez les nucléotides. Cela permet d'étudier leurs propriétés lors de synthèses in vitro, et de les comparer à celles des ARN actuels.
D'autres édifices moléculaires peuvent également présenter des capacités de reproduction, d'évolution et d'exploitation d'un milieu. Ainsi, une molécule unique comme l'A.R.N.I. (adénine-ribose-naphtalène-imide) est capable de se "reproduire". Sous l'influence de rayonnements U.V., une population de molécules légèrement différentes se constitue: on retrouve une quasi espèce. Une autre molécule, la di-aminotriazine xanthène-thymine (DIXT) présente également cette capacité d'évolution. On peut noter que l'adénine entre fréquemment dans leur composition, ce qui est intéressant car nous avons vu que la synthèse prébiotique de cette molécule est connue.
Nous pouvons donc en déduire que les premiers précurseurs des acides nucléiques étaient des polymères riches en adénine, capables de s'apparier mais pour lesquels l'autoreplication n'était pas, dans un premier temps, une condition indispensable: l'important était que ces molécules puissent prendre un grand éventail de formes différentes, permettant l'émergence des propriétés de réplication.
· L'indispensable mécanisme de couplage énergétique
Certains composés comme le carbodi-imide (-N=C=N-) fournissent assez d'énergie pour une polymérisation. D'autres agents de couplage sont le cyanogène, le cyanamide, les cyanoacétylène et le diaminomaléodinitrile, toutes molécules disponibles dans le milieu interstellaire mais également dans les atmosphères des planètes joviennes. Dans ces molécules, l'énergie est stockée dans une triple liaison CC ou CN.
- une réaction dans un milieu pauvre en eau: poussière interplanétaire avec apport continu d'énergie résultant du rayonnement stellaire, atmosphère jovienne
- la liaison entre les monomères et des ions phosphates a pu favoriser ce couplage au détriment de l'eau. Par cette voie, on a obtenu expérimentalement des synthèses de polyphosphates, composés qui sont utilisés encore de nos jours par certaines bactéries qui stockent leur énergie dans des corpuscules à polyphosphates de leur cytoplasme.
- la formation de pyrite à partir du sulfure d'hydrogène, sous haute température et pression fournit du pouvoir réducteur à un métabolisme primitif. C'est l'idée défendue par le Dr G. Wachtershauser, ces réactions se produisant à fortes température et pression, sans doute au niveau des "fumeurs noirs" sous-marins.
Faisons le point: nous avons vu que les acides aminés peuvent être synthétisés dans le milieu interstellaire, et s'y assembler en peptides. Ces poussières contiennent également des molécules que l'on retrouve actuellement dans les membranes cellulaires, et nous avons conjecturé que les précurseurs des acides nucléiques devaient également pouvoir s'y former. Ces poussières, tapissées de molécules organiques variées, forment ce que j'appellerais la "pré-vie" et sont largement distribuées au sein de la galaxie, ou elles forment des nuages, contaminent les différentes planètes et participent à la formation de corps célestes tels que les noyaux cométaires.
Parallèlement, nous avons établi que des synthèses pouvaient se produire au niveau de différentes planètes, renforçant ainsi l'action de la "manne céleste" et assurant une large distribution des briques du vivant. Il va nous falloir à présent décrire l'assemblage de ces constituants. Nous partons des pré-ARN et des peptides adsorbés sur des surfaces minérales. Il est très important de voir que dés le départ, "ARN" et peptides sont liés. En effet, leurs lieux de synthèse sont identiques, ces molécules s'enchevêtrent en se repliant et les peptides stabilisent les ARN formés. Cette stabilisation est d'une grande importance car elle est à l'origine des liens qui unissent depuis l'origine les acides nucléiques aux protéines. Cela explique pourquoi vouloir synthétiser dans des conditions prébiotiques des acides nucléiques sans la protection de peptides est une démarche si difficile: elle ne correspond pas aux conditions réelles dans lesquelles ces molécules se sont formées!
Nu, l'ARN est une molécule fragile. Comme elle est capable de se replier sur elle-même, cette molécule prend des formes variées dépendantes de sa séquence et du milieu où elle se trouve. Il en est de même pour les peptides. Comme les lieux de synthèse de ces molécules étaient les mêmes, je propose que les deux types se soient associés sur la base d'une simple complémentarité topologique: seuls les acides nucléiques dont la forme était protégée par des peptides ont pu survivre dans le milieu et se dupliquer ultérieurement.
Cette protection des acides nucléiques s'observe toujours de nos jours au cours de l'assemblage de certains virus, comme celui de la mosaïque du tabac par exemple. Il se compose seulement d'un ARN de 6400 bases de long et de 2130 exemplaires d'une protéine comportant 158 acides aminés. Chaque protéine a la forme d'une marche d'escalier telle que l'on en trouve dans les tours des châteaux, et contient une gouttière dans laquelle l'ARN vient se fixer. Les protéines seules s'assemblent spontanément pour former une rondelle, puis l'ARN viral vient placer une boucle au centre de la rondelle, et se lie à une protéine. C'est l'ARN lui-même qui déforme alors la rondelle qui prend une forme hélicoïdale: l'ARN se loge dans son sillon. Un autre disque vient se lier à l'ensemble, est à son tour déformé par une boucle de l'ARN et, petit à petit, la structure s'allonge pour former un cylindre dans lequel l'ARN est lié aux protéines dont il dirige l'assemblage et qui, en retour, lui offrent une protection. Cet emballage est très performant: alors que l'ARN nu est extrêmement fragile, le virus de la mosaïque du tabac est un des plus résistants qui soit connu. L'ARN n'agit pas ici sur les protéines par une suite de réactions chimiques complexes: c'est sa forme seule qui suffit à guider l'assemblage des protéines.
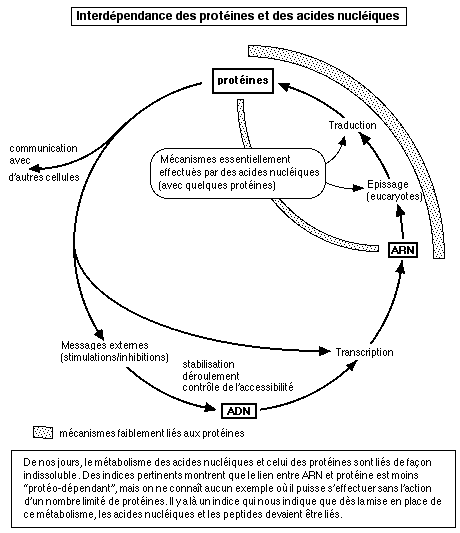
Un autre exemple de coopération entre acides nucléiques et peptides nous est donné par les ribosomes, ces organites indispensables à la synthèse des protéines: alors que l'on a longtemps cru que les protéines ribosomiales réalisaient l'essentiel du travail, des études récentes ont montré que c'était surtout l'ARN qui était actif, les protéines jouant uniquement un rôle de protection et de "contention". Même au cours de l'assemblage d'un ribosome (chez la bactérie E-coli), ce dernier est obtenu en ajoutant de façon séquentielle des protéines à un ARN préexistant. Six protéines se fixent directement à l'ARN et facilitent alors l'intégration d'autres protéines: ici aussi un processus ancestral nous montre une association directe entre ces deux familles moléculaires.
Il y a donc bien là les traces d'une collaboration entre protéines et ARN. On peut remarquer que cette coopération passe, chez le virus de la mosaïque, par un ensemble de liaisons impliquant trois nucléotides de l'ARN pour une unité protéique. On se retrouve ici avec une région liée qui comprend un triplet de nucléotides, tout comme dans le code génétique: trois bases constitueraient elles le "minimum topologique" permettant une liaison directe avec des acides aminés?
Sur les planètes telluriques, les briques de la vie peuvent s'associer à des minéraux endogènes mais elles restent dépendantes de la poussière dans les atmosphères des planètes joviennes. Dans les deux cas, la "pré-vie" d'origine interstellaire va rencontrer une molécule à la fois indispensable pour la suite des événements et terriblement dangereuse: l'eau à l'état liquide.
Le milieu liquide va permettre l'apport de minéraux, permettant à des cristaux de se développer. La formation des peptides et des précurseurs des acides nucléiques est orientée par la géométrie de ces catalyseurs minéraux. Leur croissance permet d'étendre et de reproduire non seulement leur forme mais aussi la répartition de leurs charges électriques, ce qui multiplie les lieux de synthèse. La reproduction n'est alors que minérale, les composés organiques se contentant de suivre le mouvement. En même temps que ces synthèses minérales, le milieu liquide est le siège d'un enrichissement en composés susceptibles de former des membranes.
|
Certains considèrent que la probabilité d'apparition de la vie est si faible que celle-ci ne peut exister que sur Terre. Outre que la "diaspora bactérienne" met à mal une telle conception, d'autres arguments peuvent être invoqués pour justifier une "exception terrestre". Réglons leurs compte avant de poursuivre. En milieu aqueux, les phénomènes de diffusion et d'hydrolyse s'opposent à une forte probabilité de polymérisation: les réactions chimiques à la base du vivant se sont déroulées dans un contexte bidimensionnel. Cela change fortement les conditions du problème dans lesquels hydrolyse et diffusion n'interviennent plus du tout de la même façon. Le second principe de la thermodynamique s'oppose de prime abord à la production de structures complexes: outre que ce principe reste à ce jour très vague, les réactions chimiques caractérisant le vivant sont autocatalytiques. Se produisant hors équilibre, avec échange de matière et d'énergie avec l'environnement, elles peuvent fort bien aboutir à la mise en place de structures dissipatives (auto-organisées) comme le sont les cellules de Bénard formées par les courants de convection. Les réactions autocatalytiques, non linéaires, peuvent engendrer des systèmes de forte complexité, ce que révèle l'étude générale de leur comportement à long terme (c'est un cas de dynamique non linéaire des systèmes dissipatifs) dans lequel interviennent les notions complexes de chaos dynamique, d'attracteur et de dimension fractale. L'absence de déterminisme implique une apparition des structures complexes "au hasard". (Nous existons parce que nous avons gagné au loto de la soupe prébiotique). La complexité ne sort pas du néant. Le concept d'évolution moléculaire, d'amélioration successive de produits existant s'oppose à cette conception. Une expérience in vitro nous le démontre: une enzyme d'origine virale, la Q réplicase, reproduit une séquence S d'ARN. Le tube de départ S0 contient S, des nucléotides triphosphatés servant de "briques" et l'enzyme. Toutes les 30 mn, on prélève une fraction du mélange réactionnel et on l'incorpore dans un tube contenant de l'enzyme et des nucléotides triphosphatés. On obtient S1. On continue ainsi jusqu'à S100. Comme l'enzyme produit des erreurs de réplication (1/10000), on s'attend à aboutir à une population polymorphe d'ARN, avec une sélection aboutissant à la prédominance de séquences courtes, rapidement répliquées, et de séquences de forte affinité pour l'enzyme. Les erreurs se produisant au hasard lors de la copie, on devrait obtenir un ensemble de séquences obtenues au hasard, sans déterminisme. Que nenni! On obtient une population très homogène de séquences Sh différentes de S... De plus Sh dépend bien plus des conditions initiales que de la séquence S! Il y a eu de façon quasi-déterministe sélection d'une forme particulière d'ARN parmi les 10120 possibles... Inutile donc d'essayer toutes les possibilités (on avait au maximum 1016 molécules d'ARN/tube, soit 1018 essais tout au plus...) pour arriver à un résultat a fortiori hautement improbable... La sélection naturelle s'appliquant aux molécules elles-mêmes aboutit donc à un ensemble de processus quasi-déterministes. |
On peut se demander comment nos premières formes de vie vont pouvoir se "nourrir", donc se procurer les molécules et l'énergie leur permettant de conserver leur forme et de la propager. Deux hypothèses se présentent.
Des architectes de pierre sont les bâtisseurs de la vie
Les premiers métabolismes sont des réactions s'effectuant en deux dimensions, sur des surfaces minérales. Pourquoi cette implication du minéral? Tout simplement pour pouvoir expliquer l'émergence d'un ordre, celui des molécules et des processus biologiques, à partir d'un autre ordre préexistant, qui est celui de l'arrangement des cristaux dans les minéraux. Cette condition "entropique" a été clairement énoncée pour la première fois par le Dr. Wachtershauser, qui présente le scénario le plus achevé à ce jour concernant l'apparition d'un métabolisme primitif autotrophe.
Dans celui-ci, l'incorporation du carbone est assurée grâce au pouvoir réducteur (électrons) provenant de la formation de cristaux de pyrite (FeS2). Nous avons vu que ce minéral est aussi présent dans la poussière interstellaire. On peut donc supposer que des réactions similaires puissent, si les autres conditions sont réunies, s'y déclencher aussi. On obtient ainsi un cycle correspondant à une version archaïque du cycle de Krebs, permettant l'incorporation du carbone dans des molécules organiques et la production d'énergie. Les intermédiaires réactionnels, électriquement chargés, peuvent rester liés de façon électrostatique (tout comme un peigne peut attirer vos cheveux) à leur substrat minéral.
Expérimentalement, il a été vérifié que l'on peut former des liaisons peptidiques avec du CO et des sulfures métalliques (Ni, Fe). On obtient ainsi des dipeptides, voire quelques tripeptides. La formation de ces liaisons nécessite de l'énergie. celle-ci peut être fournie par le cycle du CO, des diketopiperazines et carbo-di-imides ou du cuivre en solution salée. Cependant, le mélange Cu/NaCl semble avoir été rare dans les conditions primordiales généralement invoquées, et les carbo-di-imides, eux-mêmes organiques, ainsi que les di-ketopiperazines semblent plutôt être les molécules qui se forment en priorité, les acides aminés comme la glycine n'étant qu'un sous-produit de leur synthèse.
La fixation du CO2 peut également permettre la synthèse d'acide urique, lequel peut être considéré comme une purine très oxydée. Les premiers acides nucléiques pouvant se former auraient alors été les ancêtres de purines. Cependant, les premières bases puriques, simplement liées à un support de trioses phosphates n'auraient pas, au début tout du moins, contenu d'information: ce qui se reproduisait, c'était tout d'abord des cycles métaboliques dont la divergence était assurée par les phénomènes de croissance du support minéral.
Les premières formes de vie autotrophes auraient donc été des structures planes, fixant le carbone, croissant grâce à leur support minéral et non délimitées par une membrane. L'individualisation (séquestration) dans une membrane protéo-lipidique sera un stade suivant de l'évolution de ce probionte, suivie ensuite par la disparition du support minéral de type pyrite lorsque les polymères biologiques deviendront capables d'autoreproduction.
Le plus grand danger pour de tels "organismes" était encore la dilution, voire l'hydrolyse. Je pense que seuls ont pu subsister les ensembles délimités par une enveloppe fortement hydrophobe, capable de fixer des éléments minéraux afin d'accroître sa résistance mécanique.
De nos jours, certains micro-organismes vivant dans des milieux pauvres en oxygène présentent un métabolisme lié aux minéraux: a température élevée (60°C) et en milieu légèrement basique, l'eau réagit avec les silicates ferreux des basaltes, ce qui provoque la mise en solution d'ions Fe2+ et d'hydrogène. Des bactéries utilisent ce dernier pour leur métabolisme anaérobie. L'hydrogène sulfuré H2S est également utilisé de nos jours par les bactéries endosymbiotiques des vers tubicoles Riftia pachyptila, vivant à la sortie des "fumeurs noirs", des sources chaudes abyssales riches en composés chimiques élémentaires.
L' émergence de la vie est l'émergence de la forme
Les fonctions des grosses molécules biologiques, nous l'avons vu, découlent plus de leur forme que de leur composition chimique. Ainsi, bien que la séquence d'une protéine conditionne son repliement, toute séquence donnant une forme repliée identique donnera, au final, une fonction semblable ou similaire! Le repliement des protéines, par exemple, dépend de deux facteurs:
- leur séquence en acides aminés, qui va être à l'origine de deux types de superstructures (structure secondaire): les acides aminés se disposent en hélice ou en feuillets. La transition hélice --> feuillet est impliquée dans de nombreux phénomènes pathologiques (fibroses, encéphalopathies): une même séquence peut donc conduire à des formes différentes en fonction du deuxième facteur.
- l'environnement de la molécule. Si celle-ci se replie en milieu aqueux, les acides aminés hydrophiles seront à l'extérieur de la molécule. En milieu apolaire, lipidique, ils seront internes. De même, la répartition des charges électriques dans le milieu, ainsi que son pH ou les autres molécules présentes peuvent conditionner le repliement de la molécule bien plus que ne la dirige sa séquence. C'est pour cela que de nos jours, alors qu'il est relativement facile de séquencer une protéine, nous ne savons pas déduire sa forme de sa séquence: on doit toujours utiliser les techniques d'analyse de diffraction aux rayons X sur un cristal de protéine (difficile à obtenir!) comme dans les années 60.
La même situation se retrouve pour les acides nucléiques: plus que leur séquence, c'est leur repliement, leur appariement et leur structure spatiale qui sont à l'origine de leur activité. Les ARN de transfert agissent en fonction de leur forme, l'ADN s'enroule, se surenroule et se déroule, exposant ou protégeant des séquences qui peuvent être transcrites ou non, les ARNm se replient et se découpent... ces phénomènes sont intimement liés à la forme des molécules: d'immenses séquences de l'ADN sont très variables, non transcrites, sans utilité connue et les mutations peuvent s'y accumuler parce qu'elles ne perturbent pas le repliement dans l'espace des macromolécules: la fonction découle de la forme, laquelle dépend à la fois d'une partie de la composition chimique d'importance variable et de l'environnement de la molécule.
Sans arrêt, nos molécules se tortillent, changent de conformation: l'ADN, par exemple, est bien moins une statique (un bloc de données) qu'une dynamique (une forme). Cette célébrissime molécule ne doit ses propriétés qu'à sa forme, qui n'est conditionnée qu'en partie par la séquence des éléments chimiques dont il est constitué (il peut d'ailleurs adopter plusieurs conformations selon l'environnement).
Il en résulte qu'a l'échelon moléculaire, créer une forme revient à créer une fonction. Cette voie est expérimentalement explorée par les spécialiste de chimie supramoléculaire, qui tentent de créer des "enzymes de synthèse" et des molécules autoréplicatives simples.
Dès lors, nous devons rechercher la première forme de vie, au sens littéral du mot! Quel est donc la première forme contenant tous les éléments nécessaire à la vie et que l'on va retrouver assez largement distribuée pour permettre le développement de celle-ci? Si vous avez bien lu tout ce qui précède, la réponse vient immédiatement: c'est la poussière interstellaire, et nous allons voir qu'elle fournit tout ce qui est nécessaire à la première forme de la vie: l'ancêtre des ribosomes.
Nous en sommes au stade où des particules minérales d'origine interstellaire sont recouvertes d'une couche moléculaire comprenant des peptides, des terpènes et les ancêtres des acides nucléiques intégrant de l'adénine (6-amino-purine). Ces grains ont une taille comprise entre 2 et 1000 nm, et ils peuvent atteindre les surfaces planétaires soit directement, soit par le biais des comètes dont ils sont à l'origine dans les régions les plus externes du système solaire.
Sur les planètes telluriques à océan, ces grains flottent dans l'eau, se déposent sur le fond et les rives. Certains restent en suspension dans l'atmosphère, et servent de germe permettant la condensation de la vapeur d'eau en pluie. Au contact de l'eau liquide, les molécules qu'ils emprisonnent s'orientent et forment des gouttelettes sphéroïdales. Certaines s'échappent du grain, d'autres y restent bloquées, au voisinage des autres molécules organiques plus complexes. Des processus similaires se déroulent dans "l'océan suspendu" des atmosphères joviennes.
Sur les planètes telluriques, la disponibilité de minéraux en solution permet la croissance des composés cristallins de la poussière interstellaire, reproduisant et entraînant celle des molécules organiques, acides nucléiques et peptides, qui y sont disposés. Un apport supplémentaire de matière organique est dû à l'activité volcanique de ces planètes: au cours du refroidissement des gaz d'origine éruptive, le CO et l'hydrogène émis réagissent pour former des molécules organiques, des acides aminés et, peut être, des polymères. Ces réactions se produisent vers 200 ou 300 °C, enrobant les fines poussières minérales d'une pellicule organique: on retrouve une structure voisine de celle que nous avons rencontrée sur les grains interstellaires. De même, un composé minéral contenu dans la lave, la magnétite, joue le rôle d'un catalyseur indispensable à ces synthèses. Dans ces milieux, on peut donc dire que, comme dans nombre d'anciennes cosmogonies, la vie va naître des noces du ciel et de la Terre.
Nos grains, que désormais j'appelerai paléoribosomes, ne manquent donc pas de monomères pour poursuivre leur croissance! Dés lors, les paléoribosomes, attachés à des membranes primitives, voient leur complexité et leur taille s'accroître. Ils contiennent des peptides de plus en plus longs, de plus en plus repliés et complexes. Les acides nucléiques deviennent, à force de diversification, de sélection et peut-être de complexification, capable d'auto-reproduction. Quelle est l'origine de la pression de sélection qui pousse les acides nucléiques vers une complexité suffisante pour atteindre une autoreproduction indépendante à terme de tout support minéral? Tout simplement l'obligation qu'ils ont de devoir résister à l'hydrolyse, et pour cela de posséder une séquence leur permettant de se replier de façon correcte. Comme ce processus de repliement et multiplication moléculaire est plus rapide que la croissance cristalline, les riboparticules qui contiennent ces séquences se "reproduisent" et croissent de plus en plus vite. Leur masse augmentant, elles ont tendance à s'enfoncer dans le milieu liquide, générant ainsi des tractions et des contraintes de plus en plus grandes sur les membranes liées aux peptides, et jouant peut-être un rôle de "flotteur". Ces forces de tension superficielle sont sans doute à l'origine du repliement des membranes.
Nos agrégats se dupliquent au niveau nucléique, mais pas au niveau protéique (qui ne sont pas, pour la plupart, autoreplicantes). Il en résulte que seules les séquences autoreplicantes capables, par leurs conformations, de diriger des synthèses peptidiques, sont favorisées: c'est l'origine du transfert d'information entre acides nucléiques et protéines, le début du code génétique.
Ce point est d'une grande importance: personne, à ce jour, ne sait pourquoi les acides aminés ont pu s'associer aux acides nucléiques. A ma connaissance, je suis le premier à proposer l'idée d'une sélection moléculaire conjointe causée par une pression du milieu. La situation est simple: soit les acides nucléiques autoreplicants ont une forme capable de favoriser la liaison avec certains acides aminés et ils sont protégés de l'hydrolyse, soit ils ne l'ont pas et ils finissent... dissous. Cette dissolution sélective fournit en outre une source de nucléotides pour de nouvelles synthèses "in situ". On peut en effet imaginer certaines séquences réussissant leur "examen de survie alors que d'autres, voisines, sont recalées et servent de source de matériaux pour la reproduction des reçues... La cinétique de ce type de mécanisme aboutit très vite à la constitution d'ensembles stables de certaines séquences, auxquels on donne le nom de quasi-espéces.
Les peptides liés aux acides nucléiques, à force de se replier, acquièrent des formes qui facilitent les réactions chimiques: ce sont les premier proto-enzymes. Et sur quelles molécules vont-ils agir? Celles qui leur sont, géographiquement, les plus proches, c'est-à-dire les acides nucléiques. Dès cet instant, la collaboration entre enzymes et acides nucléiques prend naissance et ne cessera de s'intensifier. Comme les acides aminés peuvent aussi réagir avec des molécules composant les membranes, comme les terpènes ou les polysaccharides, la constitution d'une "frontière" avec le milieu extérieur sera également facilitée.
Les séquences d'acides nucléiques sont sujettes à mutations, à variations: une compétition se crée, et on obtient rapidement plusieurs quasi-espéces d'ARN. Cette évolution moléculaire a pu être obtenue et étudiée in vitro avec des résultats extrêmement intéressants, montrant qu'un système moléculaire auto-reproductif possède une adaptabilité proprement sidérante aux variations de son milieu (ce qui était indispensable dans l'environnement chaotique des débuts de la vie!). La reproductibilité des premiers acides nucléiques dépend de l'appariement de bases complémentaires, peut être aidé dès le début par des peptides de forme bien définie. Cette aide peptidique a permis de dépasser le seuil de 100 nucléotides au-delà duquel les erreurs d'appariement ne permettent plus la conservation d'une séquence. En milieu chaud, ces séquences devaient être riches en guanine et cytosine, mais l'existence d'une protection protéique peut permettre en fait toutes les combinaisons: contrairement à ce qu'affirment quelques biochimistes, nous ne nous sommes jamais trouvés en présence d'un "ARN nu" !
Diverses séquences se sont donc construites, certaine aptes à résister par elles-mêmes à de hautes températures, d'autres plus fragiles mais toutes encapsulées dans un ensemble protéique protecteur.
Dans les atmosphères des planètes joviennes, la disponibilité des minéraux est bien plus problématique que dans les océans des planètes telluriques. La croissance cristalline des grains interstellaires est donc plus difficile, bien plus lente, et reste sous la dépendance des apports minéraux externes et des coalescences accidentelles entre gouttelettes. Par contre, les problèmes d'hydrolyse occupent une place moindre, car l'eau n'y est pas disponible en quantité quasi-illimitée dans l'environnement alors que les molécules organiques y abondent, donnant tout son sens à un développement essentiellement hétérotrophe des premières formes de vie. Celles-ci se présenteraient alors sous la formes de gouttelettes absorbant méthane et ammoniac, et les métabolisant pour produire des protéines et des acides nucléiques. La rayonnement solaire est trop peu intense à la distance de cette planète pour avoir favorisé des comportements autotrophes basés sur la photosynthèse. L'utilisation d'autres sources de rayonnements électromagnétiques, provenant par exemple de l'intérieur de la planète, n'est cependant pas exclue. La forte gravité assure un apport important en matériaux et molécules exogènes. Nous verrons que cet effet "d'aspirateur gravitationnel" a sans doute permis une contamination de l'atmosphère jovienne par nos propres bactéries, court-circuitant peut être le lent développement d'une vie indigène.
Sur et dans nos paléoribosomes, les différentes espèces moléculaires ont pu s'organiser rapidement selon trois composantes principales, sans doute non nettement séparées, qu'il faut voir comme des distinction commodes au sein d'une population très variée de molécules d'ARN de toutes tailles et de toutes formes :
C'est à ce niveau, avant même une séquestration nette dans des cellules séparées, que c'est élaboré le code génétique commun (à 99,9 %) à tous les organismes que nous connaissons. Une des traces de cette époque se retrouve dans les rôles, très conservés dans l'évolution, des ARN non messagers. Parmis eux, les ARN interférents (ils inhibent de nombreux gènes) ont gardé la potentialité de se lier fortement à l'ADN, de changer sa forme et d'être synthétisés à par d'"épingles à cheveux" d'ARN dont une enzyme, la DICER, coupe la "boucle". On obtient ainsi des ARN doubles brin aux extrémités "libres", qui peuvent éventuellement s'ouvrir, voire se séparer afin de se fixer sur d'autres molécules. Dans le passé, ce mécanisme a peut être joué un rôle en permettant l'autoréplication des ARN.
Bien que l'on présente volontiers le code génétique comme étant universel, il existe quelques divergences selon les organismes auxquels on s'adresse. Ainsi:
- les mycoplasmes et les mitochondries utilisent UGA comme codon du tryptophane, alors que "normalement", c'est un codon STOP. Le codon AUA correspond également chez ces dernières à la méthionine au lieu de l'isoleucine.
- chez les paramécies, UAG donne la glutamine et non STOP.
Apparemment, ce code s'est dès l'origine organisé en triplets de bases (appelés "codon") correspondantes à un acide aminé. Cette organisation en triplets résulte peut-être d'un problème de topologie, le repliement de l'ARN "de réserve" n'exposant que des suites de trois bases accessibles aux ARN "de transfert". Cependant, l'examen du code génétique nous montre que ce sont surtout les deux premières bases qui sont importantes pour déterminer un acide aminé. Cela suggère qu'à un stade de l'histoire du code, seuls deux des trois nucléotides auraient été déterminants. En fait, il semble plus important de faire correspondre un type d'acide aminé à un codon plutôt que d'identifier précisément un acide aminé à un codon. Ainsi, un codon aurait signifié "ajouter un acide aminé hydrophobe" (valine ou leucine ou isoleucine) plutôt que "ajouter une valine" , instruction plus précise qui serait apparue plus tard. Cette petite variabilité des protéines produites par un même code a du provoquer des variations évolutivement pertinentes dans la séquence des protéines: une population variée s'adapte toujours mieux qu'un ensemble de copies à des conditions changeantes.
Un code à deux "lettres codantes" aurait permis de distinguer 16 types d'acides aminés. Les ancêtres des ARN de transfert auraient très bien pu se lier à davantage de bases, mais seules 2 de ces dernières auraient été déterminantes, la troisième le devenant de façon secondaire. On aurait très bien pu avoir aussi des ARNt ancestraux se liant à 7 bases de l'ARNm, par exemple, mais ne "lisant" que 3 de ces dernières.
Quelles sont les traces de cette ancienne conformation du code génétique ?
La topologie des chaînes latérales des acides aminés ainsi que le champ de forces qui leur est associé présentent des similarités avec celle de leur codon. Dans certains cas, le codon serait capable de se mouler sur les chaînes latérales. De plus, Certains acides aminés seraient capables de s'intercaler entre les bases de leur codon, se disposant de façon perpendiculaire à la chaîne d'ARN. Ce sont là des indices montrant qu'à l'origine il y avait bien un lien direct entre ARN et monomères des protéines: le code génétique ne résulte pas d'un processus aléatoire.
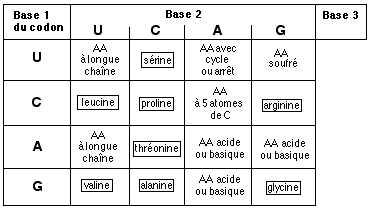
Les premiers ARN à s'être liés aux acides aminés ont constitué les ancêtres des ARN de transfert: l'ancienneté ce ces molécules est confirmée par leur forme très voisine chez des organismes pourtant très éloignés dans le temps et le champ de l'évolution.
L'universalité du code génétique limite fortement le nombre d'ancêtres communs: ce code commun nous indique qu'il n'y a apparemment qu'une quasi-espéces moléculaire qui a réussi à prendre l'ascendant sur toutes les autres. Pourquoi? La question reste ouverte, et l'on peut invoquer par exemple une meilleure disponibilité des acides aminés du code, ou une efficacité supérieure des synthèses qu'il dirige. Il faut bien voir cependant que le code génétique est redondant, plusieurs triplets correspondant à un même acide aminé. Cette redondance pourrait s'expliquer par la coexistence ancienne de plusieurs codes différents, provenant de formes de vie différentes, qui se seraient par la suite organisés en un ensemble unique, par transfert d'information résultant de processus de fusion de cellules, à l'occasion des premiers phénomènes de nutrition par exemple, ou du développement de parasites ou de virus. Le tout était de parvenir à un échange de différents ARN de transfert, dont les séquences furent par la suite incorporées dans le génome ADN, lorsque cette molécule fit son apparition.

Séquestration
et reproduction sont deux phénomènes liés
Le développement de membranes protectrices est d'une grande importance pour l'origine de la vie. Si l'on se rappelle la fragilité des polymères biologiques vis-à-vis de l'eau, un des moyens de les protéger d'une dilution fatale est de les envelopper dans une membrane fortement hydrophobe.
Dans les cellules modernes, les membranes sont constituées de protéines insérées dans une double couche de phospholipides. La synthèse de ces derniers réclame des enzymes spécialisées, et on ne peut donc pas supposer qu'ils ait été présents à l'aube de la vie. D'autres composés présentant des propriétés similaires devaient assurer leur fonction. Le point commun à des molécules devant former des vésicules au contact de l'eau est qu'elles doivent être amphiphiles, c'est-à-dire composées de deux parties: une "tête" hydrophile se trouvant spontanément vers les molécules d'eau et une "queue" hydrophobe qui se dispose avec ses consurs.
On peut obtenir dans des conditions abiotiques des composés qui vont posséder les propriétés adéquates à la formation de vésicules closes: ils ont été identifiés dans la météorite de Murchison, ce qui prouve que leur synthèse dans le milieu interstellaire est possible. Ceci a été vérifié expérimentalement par M.P. Bernstein en 1999 qui, à partir de glace d'eau, d'ammoniac et de méthanol exposée à un rayonnement U.V., a obtenu des molécules amphiphiles d'une dizaine d'atomes de carbone qui peuvent s'organiser en vésicules closes dans l'eau liquide.
Si la synthèse de ces molécules a été favorisée sur les grains d'origine interstellaire, ceux-ci ont dû se retrouver partiellement ou totalement englobés dans des vésicules qui les isolaient de l'extérieur, et en particulier du milieu aqueux. A l'intérieur de ces paléomembranes on retrouvait un milieu réactionnel hydrophobe, susceptible d'orienter des molécules, de tordre des acides aminés et de favoriser certaines réactions chimiques.
Ainsi, les molécules hydrophobes présentent dans l'eau ont tendance à s'accumuler entre les deux feuillets d'une membrane. On a donc pu avoir une liaison entre les peptides s'ancrant et prenant leur origine dans la membrane et ceux se développant à la surface des grains: les membranes auraient été alors fortement arrimées aux particules ribonucléiques, constituant ainsi les premières véritables paléo-cellules. La croissance continue de la membrane peut en outre déclencher des phénomènes de bourgeonnement, de scission en deux vésicules, comme cela a été constaté expérimentalement. Comme nous avons vu que nos particules ribosomiales peuvent se retrouver liées à la membrane, le bourgeonnement de celles-ci entraîne une scission de ces particules: la reproduction est née !
Voici ce à quoi aurait pu ressembler un des premiers organismes vivants sur les planètes telluriques: sur un ou plusieurs supports cristallins, les acides nucléiques sont reliés par des peptides à une membrane terpénique. L'évolution moléculaire tend à augmenter la taille et la complexité des peptides, qui stabilisent l'ensemble. La croissance cristalline crée des tensions sur les membranes, ce qui est à l'origine de fractionnements dont certains emportent les matériaux nécessaires au métabolisme primitif: la reproduction est en route! L'agitation du milieu peut aussi fractionner les membranes les plus développées, tout comme les ondes de choc dues aux collisions entre les planètes et des corps externes.
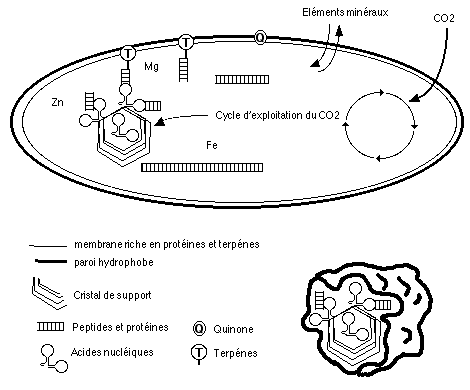
Certains des premiers organismes autotrophes fixent le carbone atmosphérique via un cycle qui fournit, outre de l'énergie, des supports cristallins. Ces derniers vont progressivement perdre de l'importance lorsque les capacités autoreproductrices de l'ARN (ou de son ancêtre) vont se manifester et s'améliorer. D'autres micro-organismes (à ce stade, nous pouvons les appeler ainsi) utilisent tant qu'ils le peuvent les substances organiques du milieu. Lorsque celles-ci se feront plus rares, seuls ceux qui seront capables d'utiliser les molécules produites par les autotrophes survivront. Les peptides et acides nucléiques, qui ont évolué dans un milieu riche en composés minéraux, utilisent ces derniers pour maintenir leur forme et leur activité biologique: c'est l'origine des cofacteurs minéraux, ainsi que du rôle joué par le zinc dans le repliement des acides nucléiques. Les cofacteurs sont des ions, des substances minérales totalement indispensables au fonctionnement des polymères du vivant. Le magnésium, par exemple, est essentiel pour tous les échanges énergétiques à l'intérieur des cellules, qu'elles soient animales, végétales ou bactériennes. D'autres minéraux, comme le fer et le soufre, forment toujours la partie active de certaines enzymes comme l'aconitase.
Dans les atmosphères joviennes, l'autotrophie n'est pas favorisée par le milieu qui est riche en molécules organiques diffusant directement dans les gouttelettes de l'océan suspendu. L'absence de pression sélective explique en partie pourquoi il n'y a pas eu développement de bactéries photosynthétiques, et donc aucun enrichissement notable de ces atmosphères en oxygène. Une autre explication est qu'à la distance de Jupiter et vu la profondeur à laquelle se trouve la couche d'eau, la lumière solaire est d'une intensité si faible que les processus photosynthétiques qui ont si bien réussi sur Terre ne sont plus adaptés. Pour qu'ils soient efficaces, il faudrait une surface collectrice énorme, et la gravité de la planète s'oppose à la constitution d'organismes de grande taille, sauf à les munir de "flotteur". Mais là, il s'agit du jeu de l'évolution, plus que celui du développement des premières formes de vie!

Peut on observer les processus que nous venons de présenter, ou espérer pouvoir les recréer expérimentalement ? Il semble que les nanobactéries soient les formes de vie qui correspondent le mieux à ce que devaient être les premières formes de vie. Les phénomènes physico-chimiques à l'origine de la vie peuvent être obtenus séparément en laboratoire, chaque étape ayant déjà fait l'objet d'études.
L'apport de matériaux extraterrestres s'est bien entendu singulièrement réduit depuis l'origine du système solaire, mais il reste non négligeable: on estime que notre planète reçoit chaque jour une centaine de tonnes de matériaux extraterrestres, principalement sous la forme de micro-météorites.
Le principal problème est que, comme le déclarait déjà Darwin, si une forme de vie nouvelle apparaissait ic et nunc, elle ne pourrait se développer à cause de la concurrence des autres micro-organismes qui peuplent aujourd'hui notre Terre. Il nous faut donc nous baser sur l'observation des formes de vie actuelles et l'expérimentation permettant de récréer in vitro les conditions de la vie primitive. Une autre voie de recherche est d'aller chercher les témoignages de la vie primitive là ou ils ont pu être conservés, c'est-à-dire, selon nos hypothèses, au niveau des nuages de gaz interstellaire et des corps qui se sont formés au début de l'histoire du système solaire, en particulier les noyaux cométaires. C'est dire l'intérêt des missions spatiales vers ces astres chevelus, dont deux sont programmées pour les prochaines années: la sonde stardust, lancée en 2000, doit collecter en 2004 des échantillons de la chevelure de la comète Wild 2 tandis que la mission Rosetta doit permettre l'analyse du noyau cométaire de Wirtanen en 2003. Si l'on couple ces données avec celles attendues de l'étude de Titan par la mission Cassini-Huygens, alors c'est au cours de cette décennie que des réponses fondamentales à l'interrogation "d'où venons nous?" nous parviendrons des confins du système solaire. Qui sait quelles nouvelles questions ouvriront pour nous ces paroles à travers l'étendue ?
Dans les chapitres précédents, nous avons présenté comment l'apparition de la vie pouvait avoir été largement répandue dans des corps différents du système solaire, et, au delà, comment l'origine interstellaire des composants primordiaux de la vie pouvait impliquer une large distribution de celle-ci à travers notre galaxie. Cette façon de voir est très loin d'être consensuelle, mais nous allons montrer à présent que même si l'élaboration de la vie se révélait plus difficile que nous ne l'avons imaginé, il suffirait qu'elle réussisse une seule fois (et de cela, nous sommes sûr!) pour impliquer l'existence de formes de vie similaires dans une large fraction des mondes de notre galaxie.