BIOCHIMIE - La chimie de la vie
Un cours en ligne de l'inénarrable Dr Fatalis - mis à
jour le 30/04/2002
Mis en chantier le 14/02/2002
Quelques notions sur la composition
chimique des êtres vivants.
|
Matière
|
éléments principaux
|
autres éléments
|
| êtres vivants (% en masse) |
O, H, C, N (95%)
|
S, P, Cl, Na, K, Ca
oligo-éléments (0,001%) : Fe, Si, Mg...
|
|
inerte
|
Al, Si, O, H
|
N: 0,03 %
|
La différence entre le monde
vivant et le monde inanimé est essentiellement d'ordre quantitatif. C,N,O
et H sont les éléments fondamentaux de la matière vivante
(ils sont largement répandus dans l'univers).
Quelle est la forme prise par ces
éléments ?
O et H sont surtout présents
sous forme d'eau, qui forme les 2/3 de la matière vivante active. La
matière séche représente environ 40 % d'un organisme animal.
Le carbone, qui représente
à lui seul 50% de la matière séche, et l'azote, qui en
représente 10%, sont les éléments fondamentaux de la
matière vivante avec l'eau.
Sur la planète Terre, être
vivant = 2/3 H2O et pour le reste 50% C, 10% N. (il y a donc
300 fois plus d'azote dans un être vivant que dans une roche).
Le carbone sert de squelette aux
molécules organiques essentielles dans de monde vivant. O, N et H forment
essentiellement des groupements fonctionnels de molécules organiques.
Na, K et leurs amis sont les sels minéraux surtout présents
en solution dans l'eau. Les oligo éléments, bien que peu importants
en masse, sont indispensables au bon fonctionnement d'un organisme (c'est
le Fer, par exemple, qui assure le transport de O2 dans le sang).
La matière vivante se divise
donc en 2 grand types de composés:
- l'eau et les sels minéraux
- la matière organique (à
base de C)
Repartition de l'eau et des sels
mineraux dans l'organisme
| Organisme = milieu extracellulaire
(lymphe, plasma ou apparenté) + milieu intracellulaire |
Un organisme un peu complexe (une
salade, vous et moi) dipose donc d'un milieu intérieur différent
de son milieu de vie.
A - Répartition de l'eau
L'eau est rencontrée dans
les 2 comprtiments: 2/3 dans les cellules et 1/3 dans le milieu extracellulaire
(dont chez l'humain 3/4 = 9 l dns la lymphe et 1/4 = 3à4 l dans le plasma)
B - Sels minéraux
La lymphe et le plasma ont sensiblement
la même composition ionique. Par contre, des différences apparaissent
si on compare milieu intra et extra-cellulaire:
|
Milieu extracellulaire
|
milieu intracellulaire
|
|
Na+, Cl -
(HCO3-)
|
K+, HPO4 2-
|
Entre ces 2 compartiments, les charges
électriques s'équilibrent et l'ensemble est globalement neutre
(des molécules organiques comme les protéines contribuent aussi
à ce bilan en apportant des charges négatives).
Bilan: L'eau et les sels minéraux
sont inégalement répartis dans l'organisme. Le milieu extracellulaire
contient surtout du chlorure de sodium (oui, du sel de cuisine!) alors que dans
les cellules nous trouvons surtout du potassium et des ions hydrogénophosphates.
Il existe dissous dans l'eau non seulement des sels minéraux mais aussi
des molécules organiques, chargées ou neutres.
Les
GLUCIDES
Les glucides sont des substances
que, dans la vie courante, on apelle sucres (à cause de leur goüt,
mais il y a des exeptions!). En fait, on distingue: les oses, glucides les plus
simlples qui ne peuvent pas être découpés par hydrolyse.
Les osides sont des glucides formés
par l'association de plusieurs molécules d'oses. Par hydrolyse, ils fournissent
des oses (mais faut pas être préssé, la réaction
est souvent lente!)
Osides + eau -----> oses
Et le morceau de "sucre"
que vous mettez dans votre café? Nous verrons qu'il est constitué
en fait de deux oses, c'est donc un oside
Dans cette introduction à
la biochimie, nous allons juste examiner les aspects les plus importants de
ces molécules, dont nous mentionnerons entre autres les rôles biologiques.
1 - Osons parler des oses
L'ose le plus connu est le glucose: vous le trouverez dans tous les
bonbons, dans votre sang, et c'est même, pour beaucoup de vos cellules,
la seule nourriture acceptable...
A - Comment est fait un ose.
Formules utilisées pour
représenter les molécules d'oses
Quels atomes rencontrent on ? Dans
les oses, on trouve C, O et H. Et puis c'est tout!
Quelles proportions? On trouve toujours
le même nombre de C et O, et 2 fois plus de H. Autrement dit, un ose a
la formule générale (Cn H2n
On)x fois.
Les oses sont, dans
les pays anglo saxons, appelés hydrates de carbone (de l'eau + du carbone).
Si il est exact que les oses sont des hydrates de carbone, la réciproque
est fausse: l'acide lactique produit par vos muscles lorsqu'ils se fatiguent
(formule C(H2O)3) est un hydrate de carbone sans être un ose.
La valeur du n de la formule (Cn
H2n On)
est variable. quelques exemples:
Glucose: n=6 donc formule C6H12O6
Ribose : n= 5 donc C5H10O5
Fructose (sucre produit par les
fruits): n=6 donc même formule "brute" que le glucose!
Ces 2 molécules ont donc le
même "poids moléculaire" puisqu'elles contiennent les
mêmes nombre des mêmes atomes. Nos formules brutes ne sont donc
pas encore suffisante, mais elles permettent déjà de classer les
différents oses:
Ceux qui ont 6 atomes de
Carbone seront les hexoses (hexa=6 + oses): glucose, fructose, galactose...
Ceux qui ont 5 atomes de
Carbone seront les pentoses (penta=5 + oses)
Ceux qui ont 4 atomes de
Carbone seront les tétroses (trétra=4 + oses)
Ceux qui ont 3 atomes de
Carbone seront les trioses (tri=3 + oses)
Où l'on utilise des formules un peu plus précises (dites
développées)
Un ose est toujours fait d'un squelette
de carbone, non ramifié, qui porte des atomes comportant de l'O
(fonctions oxygénées) ou pas.
La nature et la position des fonctions
n'apparaissent que sur des formules semi développées, qui représentent
plus précisément les relations entre atomes.
| NB: Les atomes s'accrochent entre eux en échangant des électrons.
Les atomes ne peuvent en échanger qu'un certain nombre, jamais plus.
Le C, par exemple, peut échanger 4 electrons, pas plus. Le O ne peut
qu'en échanger 2, Quant à H, il ne peut échanger qu'un
seul électron (vu qu'il n'en a qu'un seul!). |
A tout seigneur tout honneur, commençons
par voir à quoi ressemble SAS le glucose:
Le nom des fonctions
Les groupes contenant O et H gréffés
sur le carbone peuvent porter différents noms (La chimie est une science
très organisée!). Retenons en 3 qui vont nous être utiles:
|
La fonction alcool :
OH. On la retouve dans tous les... alcools évidemment!
La fonction cétone
C=O (C double liaison O et non pas C égale O! Cela veut dire que
C et O échangent 2 électrons au lieu d'un seul.)
La fonction aldéhyde
CHOH
Un ose contient donc plusieurs
fonctions alcool, et au choix une fonction aldéhyde ou une fonction
cétone.
3 façons de représenter
le glucose: en haut, la formule "développée",
qui donne le plan de la molécule. Tous les atomes y sont séparés
par leurs liaisons, mais elle est encombrante!
Au milieu, la formule "semi-développée":
Les groupements branchés sur l'axe carboné ne sont plus
détaillés.
En bas, cette formule est plus
condensée: on y regroupe ensemble les mêmes groupements.
|
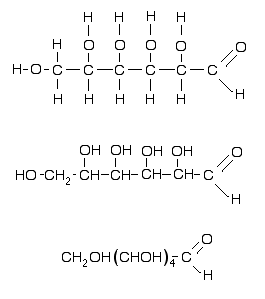 |
On peut donc classer les oses gràce
à 2 critères: nombres d'atomes de C de la molécule et présence
d'une fonction aldéhyde ou cétone.
|
Nombre d'atomes de Carbone
|
Ose avec fonction aldéhyde: aldoses (sans maccione!)
|
Oses avec fonction cétone: cétoses
|
|
6
|
Glucose
Galactose
|
Fructose
|
|
5
|
Ribose
|
Ribulose
|
|
4
|
Erythrose
|
Erythrulose
|
|
3
|
Glyceraldéhyde
|
di-hydroxy-acétone
|
Isomères en stéreo
Le glucose et son compére
le galactose ont la même formule, même semi développée:
on trouve les mêmes fonctions aux mêmes positions... (donc, vous
allez vous dire que c'est la même molécule).
Regardez vos mains (je suppose que
vous en avez 2): vous trouvez les mêmes doigts aux mêmes positions
(enfin, j'espère pour vous!). Et pourtant, une main gauche n'est pas
semblable à une main droite: vos doigts n'ont pas la même orientation
dans l'espace (cela se voit au niveau du pouce!). Pour glucose et galactose,
c'est la même chose: un atome de carbone (dit carbone "alpha"
ou asymétrique) est la "paume" de votre main, et 4" doigts"
constituent les liaisons avec le reste de la molécule:
Ces molécules dont la seule
différence réside dans l'orientation asymétrique des groupements
fonctionnels constituent des stereo-isoméres (point important,
car ils ont de nombreuses particularités chez les êtres vivants!)
On représente ces stéreo-ismères de façon normalisée
grâce à la convention de Fischer:
chaîne carbonée verticale + fonction aldéhyde "en
haut" + couples H et OH vers l'avant du plan de projection
Sur le carbone assymétrique: OH à droite: série D, OH
à gauche: série L
